Restoring vision | |
|---|---|
|
|
Обращение или замедление потери зрения является целью офтальмологии1 (Fig. 1). Хирургическое замещение хрусталика восстанавливает остроту зрения у пациентов с катарактой2, а контроль за протеканием сосудов может стабилизировать или улучшать зрение при влажной, связанной с возрастом макулярной дегенерации3. Такие воздействия имеют социальное и экономическое значение4-7. Несмотря на подобные успехи всё ещё насчитывается 285 миллионов с нарушениями зрения и 39 миллионов слепых людей в мире8. Многие состояния, вызывающие слепоту в развивающихся странах, могут быть излечены, поскольку они связаны с дефектами преломления, катарактами, инфекциями или зависят от состояния питания и проблему составляет предоставление имеющегося лечения. Но всё ещё существуют и неизлечимые болезни, включая глаукому, атрофическую макулярную дегенерацию, диабетическую ретинопатию, миопию и моногенные дегенерации сетчатки.
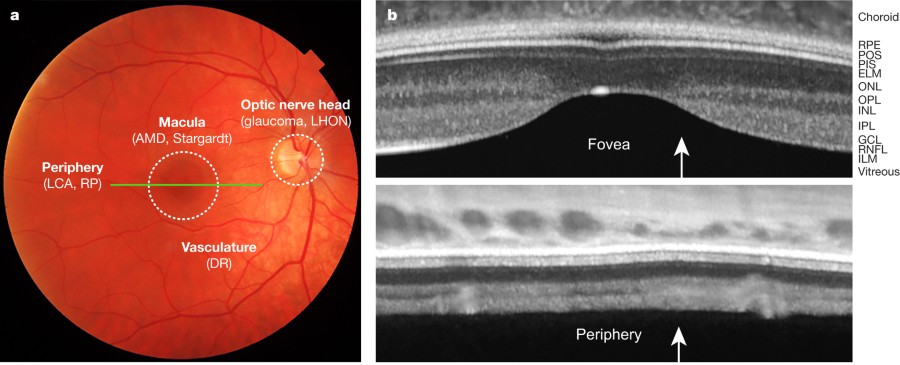 Fig. 1: The human retina in vivo.
Fig. 1: The human retina in vivo.a, The retina as seen at the back of eye by an ophthalmologist using an ophthalmoscope. Four objects can be detected: the vasculature, where diabetic retinopathy (DR) arises; the macula, the centre of which is called the fovea (age-related macular degeneration (AMD) and Stargardt disease affect this area); the optic nerve head, which is affected by glaucoma and Leber hereditary optic neuropathy (LHON); and the retinal periphery, which denotes the entire retina outside the macula, where Leber congenital amaurosis (LCA) and retinitis pigmentosa (RP) start. b, Cross sections of the retina (along the line shown in green in a) visualized using optical coherence tomography (OCT). Top: area of the macula. The fovea is marked by thinning of the retina. Bottom: retinal periphery. Different layers can be identified in an OCT image around the fovea. In general, cell body-rich layers and layers filled with liquid are darker. Layers from the vitreous towards the choroid (the layer behind the retina that is filled with capillaries) are: internal limiting membrane (ILM, the end feet of M?ller cells on the vitreal side), retinal nerve fibre layer (RNFL, ganglion cell axons), ganglion cell layer (GCL, cell bodies of ganglion cells), inner plexiform layer (IPL, connections between ganglion cells and other cells in the inner retina, such as amacrine and bipolar cells), inner nuclear layer (INL, cell bodies of inner retinal neurons such as amacrine and bipolar cells), outer plexiform layer (OPL, connections between bipolar cells and photoreceptors), outer nuclear layer (ONL, photoreceptor cell bodies), external limiting membrane (ELM, the end feet of Muller cells on the choroidal side), photoreceptor inner segments rich in mitochondria (PIS), photoreceptor outer segments (POS), retinal pigmented epithelial cells (RPE), choroid. Distinct but fewer layers can also be distinguished in an OCT image of the retinal periphery, where the retina is thinner. White arrows show the direction of light. Замещение хрусталика после катаракты и контроль за истечением жидкости из сосудов сетчатки при возрастной влажной макулярной дегенерации имеет сегодня стандартное клиническое лечение2,3. В последнюю декаду засвидетельствованы новые разработки в медицинской технологии, приводящие к восстановлению зрения или замедлению потери зрения при болезнях слепоты, обусловленных клетками сетчатки. Ключевым примером является генотерапия для Leber congenital amaurosis (LCA)9,10,11, которая вызывает достоверное улучшение зрительных реакций у молодых взрослых пациентов11,12, каки повышение активности13 и долговременной структурной пластичности14 зрительной коры. Это демонстрирует безопасность генотерапии и потенциальную выгоду для пациентов15. Первоначальные результаты др. испытаний генотерапии с вовлечением состояний, таких как болезнь врожденной слепоты choroideraemia, также продемонстрировали возможность успеха16,17. Вторым примером является электрическая стимуляция сетчатки у взрослых пациентов с дегенерацией фоторецепторов18, которая вызывает зрительные восприятия и в некоторых случаях предоставляет форму зрения19,20. Эти результаты показывают, что информация может перемещаться от сетчатки в высшие зрительные области у слепых пациентов, если зрительный нерв остается неизменным. Третьим примером является трансплантация пигментных эпителиальных клеток сетчатки позади сетчатки, это создает возможность зрительного улучшения или стабильного зрения у некоторых пациентов с возраст-зависимой макулярной дегенерацией21,22 или болезнью Stargardt21, моногенной формой макулярной дегенерации23. Контролируемы исследования на больших группах пациентов необходимы для верификации улучшений зрения, однако, безопасность таких трансплантаций обязательна24.
В здоровой зрительной системе светом управляемые онтогенетические события происходят во время первых лет жизни, в так наз. критические периоды25. Действительно ли восстанавливаются производительность сетчатки у пациентов с врожденной слепотой после критического периода, приводя к улучшению зрения. Ряд пациентов с врожденной катарактой, которая препятствует формированию визуального изображения на сетчатке с рождения, подвергается хирургическому замещению хрусталика после 8-летнего возраста. Это приводит к приобретению образцового зрения26-28 и демонстрирует, что отсутствие зрения с высоким разрешением во время первых лет жизни не обязательно предупреждает приобретение подходящего зрения после лечения.
The problem of retinal repair Почему трудно замедлить прогрессию потери зрения или восстановление зрения после его потери? 5 центральных проблем.
Первая, без вмешательства, прирожденная регенерация сетчатки млекопитающих полностью отсутствует. Это контрастирует с некоторыми др. животными, такими как рыбы, у которых происходит генерация новых клеток сетчатки и регенерация частей поврежденной сетчатки после повреждений даже у взрослых29.
Вторая, сетчатка является биологическим компьютером, состоящим из свыше 100 разных типов клеток, которые формируют специфические синаптические соединения и располагаются в самостоятельных microcircuits30,31 (Fig. 2). Типы клеток сетчатки отличаются по своей физиологии, морфологии и паттернам генной экспрессии32,33. Как следствие подобного разнообразия типов клеток, многие болезни зрения ограничены специфическим широким или узким типом клеток , поскольку вызывающие болезнь гены экспрессируются в субнаборах типов клеток или из-за того, что ранимость является специфической для типов клеток. Чтобы снизить побочные эффекты, идеальное лечение д. быть клеточно-специфическим, но трудно достичь такого лечения даже у модельных животных. Др. следствием разнообразия типов клеток является то, что способность векторов генотерапии проникать в клетки и эффективность транскрипции с этих векторов являются клеточно-специфичными. Поэтому вектора необходимо разрабатывать для разных типов клеток34. Более того, специфические синаптические соединения в сетчатке имеют важные последствия для клеточной терапии. Репарация больной сетчатки путем введения дополнительных клеток данного типа требует, чтобы добавляемые клетки формировали контакты с естественными партнерами, это неэффективно у взрослых 35.
 Fig. 2: Cell types, circuits and computations performed by the vertebrate retina.
Fig. 2: Cell types, circuits and computations performed by the vertebrate retina.a, Retinal cell types (about 100 types) can be divided into a few major classes. The characteristic locations of the cell bodies, gross morphology and connectivity of some of these classes in the retinal periphery are shown. Photoreceptors (rods in cyan, and cones in light blue) capture light. Photoreceptors pass information to inhibitory horizontal cells (orange) and excitatory bipolar cells (dark blue). Horizontal cells feed back to photoreceptors, while bipolar cells pass information further to inhibitory amacrine cells (red) and excitatory ganglion cells (purple). Amacrine cells either feed back to bipolar cells or pass information to ganglion cells. Ganglion cells are the output neurons of the retina, sending information to the rest of the brain via their axons, which come together to form the optic nerve. This circuit layout is highly conserved across vertebrates. The retinal circuit is similar in the fovea, but the locations of the cell bodies are different: cell bodies of all cell classes except cones are displaced to the side, which allows light to hit the cones directly. The black arrow shows the direction of light. Different diseases (in parentheses) affect different cell classes. AMD, age-related macular degeneration; LCA, Leber congenital amaurosis; RP, retinitis pigmentosa; CSNB, congenital stationary night blindness; CN, congenital nystagmus; LHON, Leber hereditary optic neuropathy. b, Retinal cell types are organized into about 30 circuits, each of which receives input from the mosaic of photoreceptors and ends with a mosaic of ganglion cells of a given type that forms the retinal output. There are about 30 types of ganglion cell and the retina therefore creates about 30 different image representations (three examples are shown at the bottom) of the original image that enters the eye (the face at the top). The retina is thus a parallel image processor that describes to the brain the image that falls on the retina using its own 'language'. Третья, часто предполагается. что находки у мышей могут быть непосредственно перенесены на людей. Хотя общая клеточная архитектура сетчатки сходна у мышей и людей, два вида обладают определенными различиями36, которые осложняют перенос данных. Имеются различия в композиции типов клеток сетчатки, в специфичной для типов клетоек экспрессии генов и в организации сетчатки на макроскопическом уровне. Напр., сетчатка человека содержит миниатюрные ганглиолярные клетки и связанные с ними ретинальными связи (circuitry)37, но сетчатка мышей их не содержит. Миниатюрные клетки, как полагают, обеспечивают формирование зрительной картинки высокого разрешения38, а предупреждение дегенерации миниатюрных клеток у пациентов с глаукомой или диабетической ретинопатией может оказывать значительный эффект на замедление прогрессирования болезни, но этого не существует у модельных мышей. Usher I гены являются примерами различий в специфичной для типов клеток экспрессии генов у мышей и людей. Мутантные Usher I приводят к Usher I синдрому, наследственной форме слепоты, связанной с глухотой. Мышиные фоторецепторы экспрессируют Usher I белки на значительно более низком уровне39,40 , чем фоторецепторы человека и отсутствует клеточный компартмент, в котором белки локализуются в фоторецепторах человека39. Неудивительно, что мыши, несущие ту же самую мутацию, чтои пациенты с синдромом Usher, имеют нормальное зрение39. Наконец, существенное различие в организации сетчатки на макроскопическом уровне - это присутствие у людей небольшого компартмента в центре сетчатки, наз. ямкой (fovea). Она отсутствует у мышей41; фактически приматы единственные из млекопитающих имеют ямку. Ямка у человека составляет только 0.2% сетчатки42, но необходима для цветного зрения с высоким разрешением 38, и она существенна для каждодневных целей, таких как узнавание лица и чтения43. Связанная с возрастом макулярная дегенерация3 и болезнь Stargardt23 обе в первую очередь затрагивают ямку.
Четвертая, глаза приматов имеют плотную мембрану, т.наз. внутренняя ограничивающая мембрана между сетчаткой и внутренним компартментом глаза (стекловидным телом). Эта мембрана ограничивает диффузию и тем самым ограничивает эффективность векторов генотерапии, доставляемых в стекловидное тело, таких как adeno-associated viral vectors (AAVs)44. Вновь сконструированные AAVs обнаруживают слегка увеличенную периферическую экспрессию, но доступ всё ещё ограничен45. Однако, ограничение диффузии через внутреннюю ограничивающую мембрану снижается в регионе ямки (fovea) сетчатки и доставка генов с помощью инъекций AAV в стекловидное тело около ямки у приматов оказывается успешным46. Трудности трансдукции на периферии сетчатки с помощью векторов генотерапии являются важными, поскольку инъекции в стекловидное тело более доступно офтальмологам и более безопасны, чем инъекции под сетчатку45.
Пятая, область поверхности сетчатки человека очень большая (около 1,000 mm2). Она в 70 раз больше, чем у мышей (около 15 mm2)47,48. В противовес лечению малыми молекулами, которые распределяются по сетчатке, если инъецируются в глаз или вводятся в кровоток, линейное увеличение доставки генов, достигающих всех клеток данного типа в сетчатке человека пугающая цель.
New model systems Учитывая эти затруднения, связанные с репарацией сетчатки и различия между сетчаткой человека и др. видов, как можно понять болезни сетчатки человека и разработать новое лечение? Ранее исследователи использовали генетически охарактеризованные модели животных и клеточные линии для изучения болезней сетчатки и поиска стратегий лечения. Три новых модели сетчатки стали доступны в последние годы, которые могут повысить наше понимание болезней сетчатки человека и поиск нового лечения (Table 1).
Table 1 The advantages and limitations of different model systems Full size table / Human retinal organoids Простой биоптат кожи пациента с наследственной болезнью сетчатки может быть принужден в течение года сгенерировать слоистую похожую на сетчатку струкуру, наз. органоидом сетчатки. Он состоит из разных типов клеток и, по-видимому, обладает генетическими маркерами, сходными с таковыми нейронов сетчатке49-51. Или органоиды сетчатки вырастают из биоптатов от здоровых людей, и они могут быть преобразованы, чтобы содержать необходимые мутации52. такие органоиды предоставляют беспрецедентную информацию о возникновении болезней сетчатки и предоставляют контролируемую, биологически реалистическую систему, на которой возможна отработка новых лечебных стратегий. Органоиды, моделирующие болезни сетчатки пригодны по нескольким причинам. При болезнях, которые вызывают симптомы в ранний период, болезненный фенотип может возникать в органоидах, это позволяет исследовать механистические основы болезни и разрабатывать стратегии репарации. Степень, с которой органоиды сетчатки могут формировать взрослую ткань53, сегодня неясна и поэтому болезни, моделируемые органоидами сетчатки наследственных болезней, симптомы которых развиваются у пациентов позже, могут и не предоставлять относящийся к делу фенотип. Однако, такие органоиды сетчатки всё ещё пригодны для тестирования доставки генов специфическим типам клеток. Наконец, культивируемые органоиды позволяют контролировать условия роста ткани человека, подобной сетчатке, и могут быть использованы для экспериментов, ранее невозможных на сетчатке человека, такие как точное изуче6ние физических и химических стрессов (fнапр., давление, уровни кислорода или глюкозы) , которые могут способствовать прогрессированию болезни.
Post-mortem human retinas Сетчатка от людей доноров может удерживаться живой в культуре, по крайней мере, три недели после смерти54,55, а недавние усовершенствования условий культивирования могут существенно продлить продолжительность их жизни. Эта ключевая модельная система для понимания типов клеток и связей (circuits) в сетчатке взрослых людей. Запись функциональных реакций на свет при клеточном разрешении в сетчатке модельных животных in vitro вскоре станет возможной56 а дальнейшие технические усовершенствования позволят проделывать это также с сетчаткой людей. Это позволит улучшить сравнение реакций сетчатки со зрением у людей и облегчит прямые корреляции между экспрессией генов и физиологическими реакциями разных типов клетки сетчатки человека. Более того, прямой доступ к сетчатке человека может позволить тестировать векторы генотерапии, трансплантации клеток и стратегии защиты нейронов в более контролируемых условиях и с большей производительностью, чем сегодня: одиночная сетчатка человека может быть расчленена на множество маленьких кусочков, которые можно будет исследовать индивидуально.
Genetic disease models in marmosets Не-человекообразные приматы использованы для изучения зрения и потери зрения, при этом большинство классических работ проделано на макаках. Однако, трудно использовать трансгенные методы на этом виде и недавно стали использовать мартышек, как наиболее подходящую модель для трансгенных работ57. Важно, что сетчатка мартышки содержит ямку58. Поэтому мартышки могут быть использованы in vivo в качестве foveated модели болезней человека.
New translational technologies Для лечения слепоты мы нуждаемся не только в новых модельных системах, но и также в новых трансляционных технологиях. Если сегодня воздействие базируется на малых молекулах, антителах и хирургии, то новые технологии для репарации поврежденной сетчатки уже разрабатываются (Fig. 3).
 Fig. 3: Current and planned tools for treating blinding diseases.
The approximate physical sizes span six log units, and the numbers of tools delivered to the eye span 15?log units. The approximate sizes and numbers of tools delivered are shown below each tool. The complexity and sophistication of the tools increase with size, as does the difficulty of delivering treatment across a large retinal surface in vivo. The characteristics of the different tools are shown below the images.
Fig. 3: Current and planned tools for treating blinding diseases.
The approximate physical sizes span six log units, and the numbers of tools delivered to the eye span 15?log units. The approximate sizes and numbers of tools delivered are shown below each tool. The complexity and sophistication of the tools increase with size, as does the difficulty of delivering treatment across a large retinal surface in vivo. The characteristics of the different tools are shown below the images. Gene therapy Генотерапия59 возникла в момент введения AAVs60 в качестве векторов для доставки генов в интересующие клетки сетчатки61,62. AAVs легко диффунщдируют в ткани, обладают низкой токсичностью и обладают довольно устойчивой экспрессией генов, хотя их интеграция в геном человека минимальна63. AAVs имеют три важных компонента: капсиду для проникновения в клетку64, промотор, управляющий экспрессией трансгена и специфичной для типа клеток экспрессией62,65 и терапевтический ген в качестве полезной нагрузки в вирусе. Слабость AAVs в их довольно небольшом объеме переносимого, это ограничивает их использование малыми генами. Поскольку эффективность капсида и промотора зависит от типа клетки и вида, AAVs оптимизированные для мышей вряд ли будут эффективны и специфичны для типа клеток человека. Скрининг AAVs in vitro в сетчатке умершего человека54,55 и in vivo у приматов65 может идентифицировать вектора, которые будут подходить для человека. Сетчатка трупа может быть использована для идентификации типов клеток, которые подвергаются целенаправленному воздействию в сетчатке взрослых людей; сетчатка приматов может выявлять эффективность инфекции в живых глаза, имеющих ямку. Однако, учитывая эффективные AAV для доставки интересующего гена в желаемый тип клеток в сетчатке человека, остаются проблемы доставки и безопасности доставляемых AAVs для всей сетчатки человека. Защита сетчатки человека внутренней лимитирующей мембраной ограничивает инфекцию с область ямки. Субретинальные инъекции могут предоставить доступ к большой области сетчатки, но технически очень сложно и отделяет сетчатку отпигментного эпителия сетчатки, при этом существует опасность повреждений фоторецепторов66. Более того, сетчатка человека такая крупная, что одиночные инъекции AAV, скорее всего, недостаточны для полного покрытия. Несмотря на эти ограничения, генотерапия посредством AAVs, скорее всего, останется ведущей стратегией для лечения потери зрения в ближайшие годы. Доставка без помощи вирусов67-69 также разрабатывается, с помощью лазера, ультразвука и электрических разрядов, которые создают моментально поры в клеточной мембране и позволяют фрагментам РНК или ДНК проникать в клетку. Такая технология доставки вызывает временную экспрессию белка мишени.
Cell therapy Клеточная терапия обеспечивает репарацию сетчатки посредством эктопических клеток, трансплантированных, чтобы заместить поврежденные или погибшие клетки. Клетки могут быть получены из клеточных линий, происходящих из эмбриональных или индуцированных плюрипотентных стволовых клеток или напротив из органоидов сетчатки, при этом стадии развития трансплантируемых клеток могут контролироваться. Клеточная терапия посредством пигментных эпителиальных клеток сетчатки21 ,по-видимому, наиболее простая, чем с помощью ретинальных нейронов, таких как фоторецепторы, поскольку пигментированные эпителиальные клетки не требуют формирования нейрональные сигналы передающих контактов, таких как синапсы. Тем не менее трансплантированные эпителиальные клетки. нуждаются во взаимодействии с фоторецепторами, чтобы быть использованы для функционирования в сетчатке. Клеточная терапия для ретинальных нейронов более сложна, поскольку трансплантированные клетки нуждаются в миграции в правильное положение, создавая соотв. синаптические соединения и обнаруживая специфичные для типа клеток физиологические реакции. Хотя достигнут некоторый успех в трансплантации фоторецепторов в сетчатку мышей70,71, остается неясным, будут ли современные стратегии полезны и эффективны при клинических испытаниях72. Лишь небольшая пропорция трансплантированных клеток, по-видимому, выживает у мышей и образует необходимые синаптические соединения71, а перенос материала между трансплантированными и нативными фоторецепторами осложняет интерпретацию результатов73-75. Недавно трансплантировали ганглиолярные клетки, и было установлено, что они интегрируются в retinal circuits, предоставляя ещё один клеточный источник для репарации76,77; однако, пока ещё не было показано, что трансплантированные ганглиолярные клетки отращивают аксоны, чтобы достигать своих мишеней в головном мозге. Дальнейшие эксперименты с ретинальными пигментными эпителиальными клетками, фоторецепторами и ганглиолярными клетками необходимы на модельных животных и на пациентах.
Induced retinal regeneration Попытки индуцировать дегенерацию сетчатки расширили наши знания, так, у рыб, у которых происходит регенерация в поврежденной сетчатке. В ответ на повреждения сетчатки клетки Мюллеровой глияи возвращаются в состояние, подобное таковому стволовых клеток, делятся и развиваются в разные типы клеток, которые интегрируются в аппарат (circuitry) сетчатки29. Этой способностью млекопитающие не обладают, но исследования с экспериментально управляемой регенерацией продолжаются. Напр., Мюллеровы клетки мышей активируются специфическими малыми молекулами или генами, заставляющими их делиться78 и эти вновь сгенерированные клетки интегрируются в аппарат сетчатки79. Индуцированная регенерация сетчатки была использована для индукции возобновления роста аксонов ганглиолярных клеток в направлении их мишеней в головном мозге80,81. Перерезанные аксоны ганглиолярных клеток сетчатки возобновляли рост проекций в головной мозг, если получали соотв. гены, небольшие молекулы или приобретали нейрональную активность81-83. Аксоны даже достигали своих правильных клеточно-специфичных мишеней и устанавливали соединения81. Поскольку эти методы сегодня осуществимы только на животных моделях и их эффективность довольно низка, в будущем индуцированная регенерация сетчатки будет улучшена и использована.
Artificial retinal stimulation Искусственная стимуляция сетчатки с использованием электронных имплантов, оптогенетики или фотопереключения предназначена для восстановления свойств, необходимых взрослой сетчатке84,85. Видеосигнал превращается в электронный рисунок или световой рисунок в зависимости от стратегии восстановления зрения. При терапии электронным имплантом, имплант помещается в физический контакт с сетчаткой и электронный рисунок создается с помощью стимуляции электродами импланта оставшихся нечувствительных к свету клеток сетчатки. Современная продукция имплантов сетчатки предоставляет собой довольно умеренное улучшение зрения из-за частично низкой плотности и малого числе электродов в импланте20,86, а также из-за значительных расстояний между имплантированными электродами и клетками мишенями87. Кортикальные импланты составляют альтернативу ретинальным имплантам, которые обеспечивают поверхностную стимуляцию первичной зрительной коры в клинических испытаниях88. При оптогенной терапии монохроматический свет активирует светом управляемые ионные каналы, доставляемые с помощью генотерапии к оставшимся специфическим типам клеток в сетчатке слепых54,89,90. При терапии с помощью фотопереключения91, монохроматический свет активирует чувствительные к свету малые молекулы, поставляемые в клетки сетчатки, которые соединены с внутренне присущими каналами на поверхности клеток сетчатки. Теоретически этот последний подход действует с более высоким разрешением, чем электронные импланты и может активировать специфические типы клеток сетчатки, обеспечивая усиленный контроль специфических ретинальных microcircuits. На сегодня ограничениями для технологий оптогенетики и фотопереключения является то, что активация клеток нуждается сильном (bright) видимом свете и что динамические пределы на 2-3 logarithmic единицы уже92. При ряде болезней слепоты, включая макулярную дегенерацию, большая часть зрительной чувствительности потеряна в специфических регионах сетчатки, тогда как др. регионы остаются чувствительными к свету. Оставшиеся чувствительными к свету регионы, исключают или затрудняют использование яркого видимого света для активации. Хотя и возможно повысить чувствительность оптогенетических сенсоров, это часто замедляет реакции93, и тем самым исключает восстановление пригодного для перемещения зрения. Более того, поскольку динамические пределы остаются узкими, этот подход всё ещё нуждается в наружной фотокамере. Разработка оптогенетических сенсоров близких к инфракрасному спектру или фотопереключений смогли бы, наверное, облегчить проблему оставшейся чувствительности к свету. Оптогенетические подходы на сегодня находятся в ранней клинической разработке и разрабатывается высокое разрешение электронных имплантов.
Implementing technologies for therapy Различные трансляционные технологии, представленные выше, могут быть использованы в отдельности или в комбинации для лечения разных болезней. Однако, решение того, какая технология пригодна и для какой болезни и какой стадия требует детального понимания разных болезней слепоты и их естественной истории. Напр., важно различать потерю функции, которая потенциально восстановима, от потери клеток, которая необратима. В целом терапевтические стратегии зависят от стадии болезни. Если зрение тяжело нарушено или полностью отсутствует, то целью является восстановление зрения. если существенная часть зрения всё ещё присутствует, то целью может быть предупреждение и замедление дельнейшей потери.
Vision is lost Если пациент потерял полностью зрение, то необходимо восстановление зрения. Репертуар доступных технологий широк. Важно, что восстановление зрения даже в небольшом участке сетчатки является очень полезным. Большинство стратегий по восстановлению зрения, исследуемы при клинических испытаниях, имеют целью целенаправленное воздействие, чтобы остановить дегенерацию фоторецепторов.
Колбочки являются фоторецепторами, ответственными за цветное зрение высокого разрешения, при дневном свете, а палочки ответственны за зрение в условиях тусклого света. Большинство моногенных болезней прежде всего затрагивает палочки. Формы с поздним началом этих моногенных болезней, называемые пигментным ретинитом94; Leber congenital amaurosis95 , описываются как состояния, при которых симптомы пигментного ретинита присутствуют с детства. Хотя палочки у человека численно превосходят колбочки 20 к 1, поэтому индивиды без функциональных палочек могут вести относительно нормальную жизнь. Однако, по причине, до конце неизвестной, дегенерация палочек ведет вторично к дегенерации колбочек59. Это означает, что наиболее сильным эффектом от потери палочек становится последующая потеря колбочек и связанного с ними зрения. Стратегии по репарации на более поздних стадиях пигментного ретинита имеют целью искусственную стимуляцию сетчатки с использованием электронных имплантов, оптогенетики или фотопереключения. В качестве альтернативы выступает трансплантация фоторецепторов59,84,85.
Стратегии восстановления зрения касаются и болезней, при которых дегенерируют ганглиолярные клетки. После гибели ганглиолярных клеток, напр., при глаукоме и диабетической ретинопатии мало что можно предпринять. Ещё существует, по крайней мере, три способа для разработки потенциальной терапии. Во-первых, восстановление зрения до высокого уровня в зрительной системе, такой как таламус или зрительная кора посредством электронных трансплантов96 или оптогенетической стимуляции. Во-вторых, трансплантации ганглиолярных клеток77. В-третьих, трансплантация целого глаза97 или органоида. За исключением кортикального импланта осуществляемого при клинических испытаниях88, существуют подходы на ранней ст. разработки или просто теоретические рассуждения.
Useful vision remains Если пациент всё ещё обладает некоторыми остатками зрения, то наилучшим подходом является его сохранение и замедление процесса потери зрения. Главным фактором при этом является гарантия, что лечение не будет каким-либо образом ухудшать остатки нормального зрения. Второй фактор связан с распределением терапевтических агентов. Если потеря зрения прогрессирует и затрагивает всю сетчатку, то необходимы молекулы или гены, замедляющие потерю зрения - затрагивающие типы клеток по всей сетчатке. За исключением ямки поставка терапевтических агентов в небольшой участок сетчатки будет на общую дегенерацию и потерю зрения. Следовательно, подходы по замедлению потери зрения разные между болезнью, затрагивающей ямку, и болезнью, затрагивающей всю сетчатку. Поскольку мы далеки от доставки генов во всю сетчатку человека, что в будущем, скорее всего, будет связано с лечением малыми молекулами или антителами, или с использованием локальной генотерапии, продуцирующей секретируемые факторы, которые будут распространятся по всей сетчатке.
Успешным примером замедления потери зрения являются инъекции в стекловидное тело anti-VEGF антител при влажной, связанной с возрастом макулярной дегенерации; это снижение протекания жидкости из аномальных сосудов сетчатки и её деструктивное накопление (отек). Однако, поскольку этот подход существенно задерживает потерю зрения, то anti-VEGF терапия нацелена только на сосудистый компонент болезни и в основном снижает протекание сосудов. Причина и процесс усиления (напр., генетические варианты, воспаление и активация иммунных клеток и повреждения фоторецепторов) не устраняются98. При атрофической, связанной с возрастом макулярной дегенерации, клеточная терапия с привлечением трансплантации ретинальных пигментных эпителиальных клеток оказывается подходом предоставляющим наибольший эффект 99.
Нашими наиболее драгоценными фоторецепторами являются колбочки ямки (fovea), потеря которых ведет к тяжелым нарушениям зрения. Ювенильная макулярная дегенерация, включая болезнь Stargardt и атрофическую связанную с возрастом макулярную дегенерацию, в основном затрагивают колбочки ямки. Хотя болезнь Stargardt является целью генотерапии23, чаще всего мутантный ген при этой болезни, ABCA4, слишком крупный, чтобы уместиться в AAV векторе. Это обстоятельство учитывается и используется альтернативные вирусные вектора, укорочение длины гена или его сборка из более коротких кусочков внутри клетки мишени. Генотерапия с использованием ABCA4 с лентивирусными векторами с большим объемом сегодня находится на клиническом испытании100.
Недавние многообещающие разработки по уменьшению вторичной дегенерации колбочек осуществлены у животных моделей пигментного ретинита. Обеспечение происходящим из палочек факторами жизнеспособности колбочек101-103 или активация его рецептора104, или доставка генов, противодействующих активному голоданию105,106 или оксидативным стрессам107, как было установлено, снижает дегенерацию колбочек у животных моделей и предлагается для лечения людей. Голодание108,109 и оксидативный стресс110,111, по-видимому, являются главными вкладчиками в дегенерацию колбочек после гибели палочек, поэтому питание колбочек и предупреждение оксидативных стрессов становится центральной темой в их защите. Методы, которые могут повысить доступное питание за счет усиления кровоснабжения 112, такие как стимуляция микртоков113,114, находятся на клиническом испытании, тогда как методы снижения оксидативных стрессов посредством антиоксидантов уже используются в клинической практике115.
Существуют также разработки по снижению потери зрения при Leber hereditary optic neuropathy (LHON)116. Мутации в разных генах, кодирующие митохондриальный геном, вызывают разные формы LHON. Эта болезнь является прекрасным примером специфичной для типа клеток ранимости; несмотря на присутствие митохондрий в каждой клетке тела дегенерируют только или в основном ретинальные ганглиолярные клетки. Генотерапия и терапия малыми молекулами дают заметное замедление потери зрения при LHON.
Известны случаи, когда потеря зрения связана не с проблемами сетчатки, а скорее с дефектами в др регионах зрительной системы, таких как зрительная кора. В этих случаях влияние на пластичность оставшейся части зрительной коры рассматривается как способ улучшения зрительной функции117.
Evaluating the outcome of therapy Одним из ключевых затруднений является вариабельность результатов клинических испытаний. Напр., одна группа описала увеличение зрительной функции12 после LCA генотерапии, тогда как др. группы обнаружили инициальное улучшение, которое со временем снижается118,119 или даже понижает зрительную функцию по сравнению с исходным состояние у тех 't пациентов118. Изменчивость также наблюдалась относительно улучшения зрения у пациентов с электронными имплантами. Изменчивость может возникать по многим причинам: разные способы оценки зрительной функции, измерения зрительной функции в разное время после лечения, различия в деталях векторов генотерапии и их доставки66, в деталях имплантированных устройств зрительной стимуляции, способности пациентов понимать значение измененных периферических стимулов и различия в стадиях, на которых проводится терапия.
Др. препятствием является то, что болезни дегенерации сетчатки прогрессируют и поэтому существенно изучать прогрессирование болезни прежде привлечения пациентов к клиническим испытаниям и охарактеризовать изменения при прогрессировании во время и после терапии85. Более того, новые и существующие диагностические инструменты д. использоваться для разработки стандартизованной и количественной оценки для оценки структуры и функции сетчатки и коры117, а также зрительной функции джо и после терапии.
Новые и улучшенные методы получения изображений in vivo (включая адаптивную оптику, оптическую конвергентную томографию, ультразвуковые и аутофлюоресцентные изображения) и психофизические методы (напр., microperimetry) могут помочь подобным оценкам и сравнениям благодаря определению плотности фоторецепторов, существование и длина внутреннего и наружного сегментов, состояние ганглиолярных клеток, взаимодействия между фоторецеторами и ретинальными пигментированными эпителиальными клетками, кровотока в сетчатке112, и любой остаточной функции в небольших участках сетчатки85. Результаты измерений д. быть мощными, воспроизводимыми, уместными и легко воспроизводимыми в разных центрах120-122.
Реабилитация является др. ключевым вопросом, поскольку исход терапии может быть улучшен со временем при хорошо разработанной программе реабилитации123. Улучшение может быть постепенным, поскольку соединения внутри зрительной коры могут перестраиваться во время состояния слепоты для поддержания др. познавательных функций124. Следовательно, необходимы тренировки зрения и время для приведения в порядок зрительной коры к её оригинальной функции. Более того, подходы по восстановлению зрения, при которых технологии конвергируют будут нуждаться в новых стратегиях по реабилитации. Напр., оптогенетическая терапия в комбинации с генотерапией с медицинскими устройствами затавляют таращить глаза, (a goggle). Эта технология конвергенции нуждается в разного типа экспертизе и строгих занятиях пациента во время реабилитации.
Technologies that complement vision restoration Помимо стратегий, которые недвухсмысленно восстанавливают зрение или замедляют потерю зрения, существует множество альтетрнативных подходов, доступных или разрабатываемых для передачи зрительной информации у пациентов с нарушениями зрения посредством одной из оставшихся сенсорных modalities. Классические стратегии включают использование собак проводников и тростей. Однако, цифровая эволюция повысила также способность слепых пациентов: приложения в смартфонах обеспечивают услуги благодаря использованию телефона в качестве простого детектора света или как GPS-сцепленной карты перемещения или путем осуществления голосом передаваемых сообщений (emailing), обработки текста и путешествия по web125,126. Недавно стало возможным получение определенных изображений для слепых с использованием искусственного разума127. Поскольку мощный искусственный разум увеличивается, то всё боле и более цифровых инструментов будет использоваться для слепых индивидов.
Др. технологии сконцентрированы на использовании более сложных сенсорных замен, когда оставшиеся чувства тренируются в процессе обычным образом перерабатываемой информации с помощью зрительной системы. Один из подходов связан с внесением наивысшей записывающей 'зрительной' остроты для любой из стратегий по реабилитации зрения у пациентов с нарушенным зрением - путем замены слуховым восприятием128. При этом укрепленная на голове камера записывает видимое окружение и видео сигнал затем превращается в серии звуков. Удивительно, зрительно-слуховая сенсорная замена активирует 'зрительные области' головного мозга посредством слуховой стимуляции129. Др. подходом является использование у людей эхолации, сходной с таковой у летучих мышей и дельфинов130. Хотя такие успехи могут делать жизнь легче для слепых, но целью медицины остается предупреждение потери зрения, и лечение потери зрения.
Outlook Blinding diseases of the eye, which are increasing in step with increasing human longevity, cause major social and economic burdens131. The recent developments outlined in this paper provide the hope that some of these diseases can be effectively addressed in the coming decade. Nevertheless, the challenge is severe because the retina is a biological computer and not just a simple collection of photosensitive cells. Therefore, we argue that both the diagnosis and the treatment of retinal diseases should be cell-type focused: disease by disease, we need to understand the causes and mechanisms of the death of disease-affected human retinal cell types. We must also learn to interact with retinal cell types inside the patient's eye, specifically and efficiently.
Finally, the retina, as a biological computer comprising about 100 cell types with specific rules of connectivity, is not unique. The cerebral cortex32 and some deep brain nuclei132 are both cell-type rich and have specific connectivity. The retina is in fact an outpost of the brain sitting in the eye56 and following rules similar to the rest of the brain. This is important for two reasons. First, key pathological phenomena, including cell-type specific degeneration, are shared by the retina and other brain regions. Understanding why retinal cells die and why this process is cell-type specific could enhance our understanding of neurodegeneration in general. Second, fine perturbations of the activity of specific retinal cell types are likely to occur in a variety of neurological and psychiatric diseases with a genetic or environmental origin, because the disease-associated genes are expressed in specific retinal cell types or because the environmental insult affects specific retinal cell types. The fact that the retina is visible through the lens in humans makes it the part of the brain that is simplest to study in patients in vivo. The development of new imaging techniques to record the activity of retinal cells at cellular resolution in vivo in humans would make the retina the ideal location for following the progress of brain disease and reaction to therapy.
|