Посещений: 
ЭКЗОСОМАМИ ОБЕСПЕЧИВАЕМАЯ ДОСТАВКА
Доставка генетических векторов и лекарств
Exosome-mediated delivery of gene vectors for gene therapy Li Duan a, Limei Xu a, Xiao Xu et al. Nanoscale, 2021, 13, 1387-1397 DOI: 10.1039/D0NR07622H
| |
|
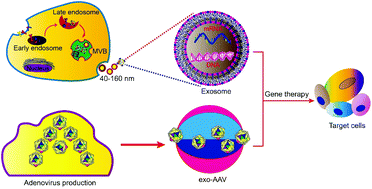 Успехи в области генотерапии вселяют надежду на лечение ранее неизлечимых болезней таких как генетические нарушения, 3 раковые опухоли, 4 и аутоиммунные болезни. 5 Кстати, по крайней мере, 943 клинических испытаний генотерапии было осуществлено во всем мире.
Для генотерапии доставая является важной. Наборы клеточных мембран служат непроницаемым барьером для негативно заряженных нуклеиновых кислот. Также генетические материалы являются ломкими в теле человека, так что они д. быть защищены, чтобы оказывать эффект. мРНК , вирусные и невирусные плазмиды ДНК наиболее распространенные генетические материалы для генотерапии. Напр., adeno-associated virus (AAV) вектор используется наиболее часто. 6 Однако, AAV вектор индуцирует иммунную реакцию у хозяина, это приводит к быстрой деградации или нейтрализации вектора и серьезно мешает эффективности генотерапии. 7,8 Инкапсуляция в наноструктуры, такие как экзосомы, защищает AAV векторы от иммунной системы хозяина и делает возможной их доставку через клеточные мембраны. 9,10 Описывается разработка экзосом в качестве переносчиков для инкапсуляции и доставки генных векторов в клетки (Fig. 1).
 Fig. 1 Schematic illustration of exosome-mediated gene delivery strategies. Functionalized exosome encapsulated gene vectors, such as AAV, DNA and mRNA, deliver to target cells and exert functional therapies by translating into proteins, RNA interference, genome editing, etc.
Fig. 1 Schematic illustration of exosome-mediated gene delivery strategies. Functionalized exosome encapsulated gene vectors, such as AAV, DNA and mRNA, deliver to target cells and exert functional therapies by translating into proteins, RNA interference, genome editing, etc.
2. Gene therapy В 1960s Joshua Lederberg впервые представил концепцию и заложил основы лечения генетических болезней. 11 В 1972 генотерапия впервые была предложена и принята. 12 В 1989 National Institutes of Health разрешил первое клиническое испытание генотерапии, при котором использовался меченный ретровирус in vivo. 13 Это исследование продемонстрировало, что клетки человека могут быть генетически преобразованы in vitro и затем возвращены безопасно в тело пациента. 13 Первое успешное клиническое исследование генотерапии in vivo было описано в 1995. 14 Аутологичные лейкоциты от пациента с тяжелым синдромом комбинированного иммунодефицита (SCID) были откорректированы с помощью ретровируса и введены обратно. Однако, дальнейшее развития генотерапии испытало регресс из-за побочных эффектов, вызываемых аденовирусами индуцируемых летальных иммунных реакций и озлокачествления. Затем генотерапию стали использовать не только для генетических нарушений, но и для инфекционных болезней, сердечно-сосудистых болезней и аутоиммунных болезней. 15-17 С того времени как China Food and Drug Administration (CFDA) одобрила первый генотерапевтический продукт Gendicine (рекомбинантный человеческий p53 аденовирус) для лечения head and neck squamous cell carcinoma (HNSCC) в 2003, 9 продуктов были одобрены European Medicines Agency (EMA) и United States Food and Drug Administration (FDA) (Table 1). 18-29
Table 1 Gene therapy products and clinical trials
Разработка технологии CRISPR-Cas9 редактирования генов, известной как "магические ножницы" для ДНК, существенно продвинулась разработка генотерапии. 30-34 Ученые теперь могут эффективно и аккуратно изменять, делетировать или замещать гены растений, 35,36 животных, 37,38 и даже людей. 39 Два базирующихся на CRISPR терапевтических подхода подвергнуты клиническим испытаниям: CTX001 для лечение редких генетических болезней, β-thalassemia и серповидно-клеточной анемии, и EDIT-101 для лечения врожденного амавроза Leber 10, редкой наследственной болезни глаз, приводящей к слепоте. 40
3. Exosome-associated AAV vectors for gene therapy Исходя из источника переносчики доставки гена могут быть разбиты на вирусные и не вирусные системы (Fig. 2). Системы вирусной доставки генов используют модифицированные вирусы, дефицитные по репликации, но которые могут доставлять ДНК для экспрессии, включая аденовирусы, ретровирусы и лентивирусы. 41 Традиционными не вирусными устройствами являются micelles, 42,43 липосомы, dendrimers, 44,45 и углеродистые нанотрубки. 46 Недавно внеклеточные пузырьки, секретируемые клетками, особенно экзосомы, были использованы в качестве не вирусных устройств для доставки генов, они обнаружили высокую биосовместимость, низкую скорость удаления и пригодность для целевой доставки в клетки. 47-50 Гибридные технологии генной доставки, такие как exosome-AAV гибриды, комбинируют вирусные векторы с не вирусными устройствами и обнаруживают существенное снижение иммуногенности. 51,52
 Fig. 2 A summary of gene delivery carriers. Current gene delivery carriers contain three major categories: non-viral vectors, viral-vectors, and combined hybrid vectors. Commonly used non-viral vectors include synthetic vectors, such as lipid nanoparticles, polymer nanoparticles, and dendrimers, and biological vectors, such as exosomes. A hybrid gene delivery system based on exosome-associated AAV (Exo-AAV). Most synthetic vectors mainly enter endosomes and later lysosomes. Exosomes and Exo-AAVs enter cells via multiple pathways, such as membrane fusion and various types of endocytosis pathways such as phagocytosis, macropinocytosis, and lipid raft-dependent and clathrin-/caveolin-mediated endocytosis. Fig. 2 A summary of gene delivery carriers. Current gene delivery carriers contain three major categories: non-viral vectors, viral-vectors, and combined hybrid vectors. Commonly used non-viral vectors include synthetic vectors, such as lipid nanoparticles, polymer nanoparticles, and dendrimers, and biological vectors, such as exosomes. A hybrid gene delivery system based on exosome-associated AAV (Exo-AAV). Most synthetic vectors mainly enter endosomes and later lysosomes. Exosomes and Exo-AAVs enter cells via multiple pathways, such as membrane fusion and various types of endocytosis pathways such as phagocytosis, macropinocytosis, and lipid raft-dependent and clathrin-/caveolin-mediated endocytosis.
3.1 AAV vectors Adeno-associated viruses (AAV) являются небольшими вирусами, которые инфицируют людей и некоторые др., виды приматов. Одиночная нить AAV ДНК с геномом размера 4.7 kb кодирует три гена, Rep (Replication), Cap (Capsid) и aap (Assembly), упакованные в виде икосаэдра. Два конце генов являются inverted terminal repeats (ITRs). В рекомбинантных AAV (rAAV), используемых в качестве генного вектора, все гены вирусных белков делетированы и только терминальные последовательности ITR, связанные в репликацией и упаковкой вируса сохраняются. Терапевтические трансгены и регуляторные элементы вставляются между этими ITRs. Делеция генов вирусных белков максимизирует способность трансгена в AAV и снижает иммуногенность и цитотоксичность. Поскольку rAAV вектор не экспрессирует REP белок, его способность интегрироваться в геном хозяина сильно снижена. Более того, геном rAAV может формировать длительный циркулярный тандем в ядре, реализуя тем самым длительную экспрессию трансгена. В отличие от лентивирусного вектора, аденовирусного вектора, ретровирусного вектора и др. широко используемых вирусных векторов, AAV вектора не приводят к вредным инфекциям без вирусов помощников. Поэтому AAV становятся предпочтительными векторами из-за низкой иммуногенности, низкой генотоксичности, разнообразия капсидных белков и продолжительности действия и легкой продукции.
3.2. Exosomes for gene delivery Экзосомы являются пузырьками, заключенными в двойной липидный слой диаметром в 40-160 nm, которые циркулируют во внеклеточном окружении. Они возникают в результате внутреннего отпочкования из поздних эндосомных мембран и высвобождаются всеми типами клеток. Следовательно, экзосомы являются естественными переносчиками для межклеточных коммуникаций. Эти свойства привлекли исследователей для разработки базирующейся на эписомах системы доставки лекарств. По сравнению с др. системами доставки генов, экзосомы обладают преимуществами по следующим причинам. Во-первых, экзосомы являются разносторонними переносчиками. Разнообразные биологические грузы, такие как малые РНК, мРНК и белки могут быть инкапсулированы и доставляться с помощью экзосом. Во-вторых, экзосомы обладают природной способностью пересекать биологические барьеры, напр., гемато-энцефалический барьер. Они могут также мигрировать в ткани или области, лишенные кровоснабжения, напр., плотный хрящевой матрикс. Более того, после поступления в ткань мишень, экзосомы могут оставаться в течение длительного периода времени; низкая скорость очистки может быть обусловлена био-совместимостью экзосом. Др. важным свойством является то, что экзосомы также поддаются генетическим преобразованиям. Многие цели могут быть достигнуты путем искусственного преобразования поверхностных белков экзосом, напр., нацеленные на клетки или ткани пептиды могут быть добавлены на поверхность экзосом, чтобы обеспечить избирательное целенаправленное действие на специфические ткани и избегать нежелательного накопления в др. органах, снижая тем самым системную токсичность. Исследования продемонстрировали, что базирующаяся на экзосомах целенаправленная генотерапия может улучшать как терапевтическую эффективность, так и безопасность. Напр., мы преобразовали базирующуюся на экзосомах систему доставки нацеленных на хондроциты miRNA для репарации дефектов хряща. 53 В этой работе chondrocyte-affinity peptide (CAP) был экспрессирован на поверхности экзосом и miR-140 была загружена внутрь экзосом. Внутрисуставные инъекции смеси CAP-exosome/miRNA показали избирательное и долговременное обогащение в хряще и достоверное увеличение терапевтической эффективности в отношении дефекта хряща по сравнению с инкапсуляцией miRNA в экзосомы без модификации их поверхности.
3.3 Exosome-associated AAV for gene therapy
Ассоциация с экзосомами может смягчить токсичность и уменьшить быстрое удаление AAV векторов. AAV страдают от недостатков, таких как быстрое удаление путем нейтрализации анти-AAV антител в теле и доставки помимо мишени (часто в печень). Maguire et al. продемонстрировали в 2012, что часть AAV векторов ассоциирует с микропузырьками и экзосомами. 54 AAV капсиды были обнаружены в ассоциации на поверхности и внутри микропузырьков под ЭМ. Ассоциированные с экзосомами AAVs (Exo-AAVs) были очищены от клеточного окружения (Fig. 3) преобразованы в обычные очищенные AAV векторы для эффективной трансдукции. Одной из заметных проблем AAV вектора является то, что он вызывает мощную долговременную гуморальную реакцию, включая нейтрализующие антитела (NAbs), которые соединяются с AAV векторами и подавляют трансдукцию и non-Nabs, которые метят вирус. Следовательно, NAbs негативно сказываются на эффективности AAV-обеспечиваемой генотерапии и распределении и безопасности AAV вектора. 55 Напротив, exo-AAVs более резистентны к нейтрализующим anti-AAV антителам по сравнению с обычными AAVs. Это подтверждено экспериментально. Экзосомы, ассоциированные с AAV векторами оказались значительно более резистентны к NAbs, чем AAV как in vitro, так и in vivo , а AAV9Exo-SERCA2a превзошел обычные векторы AAV в сохранении сердечных функций в присутствии или отсутствии Nabs. 56 Доставки гена Exo-AAV8 также снижала терапевтическую дозу вектора и эффективно вызывала трансдукцию даже в присутствии умеренных титров NAb. 57 Exo-AAVs также обнаруживали более высокую эффективность трансдукции в ЦНС в слуховой и вестибулярной системе. 51,54
 Fig. 3 Schematic diagram showing the different procedures for the production and purification of Exo-AAVs (upper) and AAVs alone (lower), respectively.54 Exo-AAVs are harvested from cell medium and purified by differential centrifugation, whereas AAVs are purified from cell lysates by iodixanol density gradient and ultra-centrifugation.
Fig. 3 Schematic diagram showing the different procedures for the production and purification of Exo-AAVs (upper) and AAVs alone (lower), respectively.54 Exo-AAVs are harvested from cell medium and purified by differential centrifugation, whereas AAVs are purified from cell lysates by iodixanol density gradient and ultra-centrifugation. Ассоциация AAV с экзосомами также делает возможной целенаправленную доставку. В одном случае магнитное наведение на цель было реализовано путем экспрессии biotin акцепторного пептида с трансмембранным рецептором (BAP-TM) на их поверхность путем трансдукции 293T клеток с помощью лентивируса, кодирующего BAP-TM. Комплекс vector-exosome, наз. vexosomes авт., был затем biotinylated с помощью фермента biotin ligase BirA. Биотинированный комплекс vector-exosome затем соединялся с streptavidin-functionalized магнитными кусочками и поэтому он мог наводиться с помощью магнитного поля.58 Генетическое слияние rabies virus glycoprotein (RVG) с тромбоцитами управляемым трансмембранным доменом рецептора фактора роста приводило к образованию Exo-AAVs которые могли доставлять грузы в головной мозг более эффективно, чем ненагруженные EV-AAVs.59 Сходные стратегии могут быть использованы для разработки Exo-AAVs для доставки генов в миокард.56,59,60
Продукция Exo-AAVs менее затратная. По сравнению со сложным протоколом очистки AAVs, очистка Exo-AAVs может быть просто осуществлена с помощью дражирования (pelleting), используя ультра-центрифугирование (Fig. 3). 61 Кроме того, было показано, что избыточная экспрессия CD9 может быть усилена продукцией Exo-AAV, это повышает надежды на будущее снижение цены Exo-AAVs для клинических испытаний. 62 Эти преимущества делают Exo-AAV многообещающей платформой для генотерапии. Мы суммируем в Table 2 описанные Exo-AAV системы для генотерапии. 51,52,54,56-61,63-65
Table 2 Exosome associated-AAV for gene delivery
4. Exosome-mediated delivery of CRISPR-Cas9
Наводимый CRISPR последовательностью энзим Cas9 может редактировать геномную ДНК с беспрецедентной точностью, эффективностью и гибкостью в клетках.
Однако, система CRSPR-Cas9, разработанная ex vivo нуждается в доставке в клетки мишени и организмы для генотерапии. Доставка системы CRISPR-Cas9 д. быть способна к физическому взаимодействию, химической модификации и к биологическим переносчикам. Система CRISPR-Cas9 может быть доставлена в клетки посредством временных пробелов в липидном бислое, вызываемых физическими методами, такими как электропортация, гидродинамические инъекции, деформации мембран и др. Хотя они просты и легки для осуществления, но необратимые физиологические повреждения могут быть вызваны в клеточных мембранах. Химические модификации CAS9-sgRNA также могут способствовать их доставке в клетки, а биологические переносчики, такие как бактериофаги, вирусы и внеклеточные пузырьки могут способствовать доставке CRISPR-Cas систем в клетки (Table 3).
Table 3 Comparison of the different delivery vehicles for the CRISPR/Cas9 gene editing system (N/A, not available)
4.1 Exosomes as carriers for CRISPR-Cas9 plasmids
В сравнении с вирусными переносчиками, экзосомы из определенных клеточных источников могут избирательно доставлять грузы в опухолевые ткани. 66 Kim et al. сообщили, что происходящие из раковых клеток экзосомы могут транспортировать CRISPR-Cas9 систему в опухоли мишени. 67 Система CRISPR-Cas9 после целенаправленного воздействия с помощью poly (ADP-ribose) polymerase-1 (PARP-1) была электропортирована в экзосомы из клеток линии рака яичников SKOV3 и линии эпителиальных клеток HEK293 и доставлена в раковые клетки SKOV3 и HEK293. Соотв. экзосомы, происходящие из раковых клеток, могут избирательно накапливаться в раковых опухолях яичников у мышей с ксено-трансплантатами SKOV3, усиливая их химиочувствительность к cisplatin и делая возможной взаимно усиливающуюся гибель опухолевых клеток. 67 Это исследование показало, что клеточный тропизм может наводить экзосомы, происходящие из опухоли на раковые клетки, подтверждая целенаправленное действие специфичных к опухоли белков на поверхность экзосом. Несмотря на нацеленный на опухоль эффект, экзосомы, происходящие из опухолей, переносят внутриклеточные материалы, которые могут способствовать росту и прогрессированию опухоли. Это указывает на существование баланса между за и против выбора экзосом от разных типов клеток для переноса и доставки груза.
4.2 Engineering exosomes for CRISPR-Cas9 delivery
Естественные экзосомы не предназначены для доставки гигантских молекул, таких как плазмиды; поэтому загрузка плазмид в экзосомы низкая. Экзосомы затем нуждаются в преобразованиях для повышения эффективности и сохранения способности плазмид. 68 Преобразования экзосом также обеспечивают эти доставляемые наночастицы способность целенаправленного воздействия на доставляемый груз в специфические клетки и ткани. CD63 и CD9, маркеры белков, экспрессируются на поверхности экзосом, их часто выбирают в качестве белков мишеней для преобразования экзосом. Напр., Ye et al. получили преобразованные экзосомы (M-CRISPR-Cas9 экзосомы), которые могут эффективно загружать CRISPR-Cas9 компоненты посредством межбелковых взаимодействий. Авт. сливали GFP с CD63 и GFP нанотела с Cas9 белком. Взаимодействие между GFP и GFP нанотелами заводят систему CRISPR-Cas9 в экзосомы и увеличивают грузовую ёмкость. 69 Повышение доставки генов доказано на примере линии репортерных клеток, которую создали авт. В др. примере, Li et al. сливали CD9 с РНК связывающим белком HuR, который, как известно, связывает молекулы РНК с AU богатыми элементами (AREs), такими как miR-155. Преобразованные экзосомы, содержащие CD9-HuR, обогащали экзосомы miR-155 и доставляли груз к клеткам реципиентам. CD9-HuR экзосомы могут также обогащать CRISPR-dCas9, которые были преобразованы с помощью богатых AU элементов. 3Ч AREs были клонированы ниже dCas9 стоп-кодона, и это существенно увеличивало эффективность инкапсуляции dCas9 мРНК а CD9-HuR экзосомы. 70 CRISPR-dCas9 РНК успешно доставлялась и осуществляла свою функцию in vitro и in vivo. Недавно, Gee et al. разработали временную систему доставки для терапевтического редактирования генома с использованием двух механизмов самонаведения: Cas9 белок был рекрутирован в пузырьки с помощью химически индуцируемой димеризации, а sgRNA вводилась в пузырьки с помощью сигнала упаковки вирусной РНК и двух само-расщепляющихся riboswitches. Эффективное редактирование генома затем достигалось в разных трудных для трансфекции типах клеток, включая человеческие induced pluripotent stem (iPS) клетки, нейроны и миобласты. 71
4.3 Exosome-liposome hybrids for gene delivery
Экзосомы размера наношкалы (40-160 nm) делают их подходящими устройствами для малых терапевтических агентов, таких как химические соединения, siRNAs и miRNAs. Для более крупных молекул, таких как плазмиды, экспрессируют CRISPR-Cas9, с минимальным размером 5-6 kb, способность нативных экзосом всё ещё относительно низка. 72 Липосомы, с др. стороны, способны инкапсулировать и доставлять крупные плазмиды, но демонстрируют относительно высокую цитотоксичность из-за неестественной природы липидов. Слияние липидных бислоёв мембран экзосом и липосом образует exosome-liposome гибрид, который способен инкапсулировать и доставлять крупные молекулы ДНК, такие как плазмиды, экспрессирующие CRISPR-Cas9, а также смягчать проблему токсичности липосом (Fig. 4). 73 Следовательно, exosome-liposome гибриды расширяют возможности использования экзосом для доставки лекарств. Напр., CRISPR-Cas9-sgRUNX2 был инкапсулирован в exosome-liposome гибридные пузырьки и доставлен в мезенхимные стволовые клетки костного мозга человека, которые нельзя было трансфицировать только липосомами. 71 В др. примере, Lv с сотр. разработали генетически преобразованные exosome-thermosensitive liposome гибридные наночастицы (gETL NPs) для доставки granulocyte-macrophage colony-stimulating factor (GM-CSF) и docetaxel (a chemoimmunotherapy drug) в узлы крупных опухолей, которые вызывают метастатические перитонеальные карциномы, смертельная болезнь, не имеющая лечения. Авт. показали, что комбинирование locoregional доставки hyperthermic intraperitoneal chemotherapy (HIPEC) и системного введения химиоиммунотерапии посредством gETL NPs может существенно улучшить лечение болезни. 74
 Fig. 4 Encapsulating large nucleic acids in exosome or exosome-derived vesicles. Strategies to realize efficient encapsulation include (a) interaction mediated loading of the Cas9 protein in exosomes,69-72 (b) enriching CRISPR-Cas9 plasmid in the exosome-liposome hybrid,71 and (c) nanoporation to deliver mRNA molecules into exosomes.76
Fig. 4 Encapsulating large nucleic acids in exosome or exosome-derived vesicles. Strategies to realize efficient encapsulation include (a) interaction mediated loading of the Cas9 protein in exosomes,69-72 (b) enriching CRISPR-Cas9 plasmid in the exosome-liposome hybrid,71 and (c) nanoporation to deliver mRNA molecules into exosomes.76
5 Exosome-mediated mRNA delivery for gene editing
Инкапсуляция крупных мРНК транскриптов в экзосомы затруднительна. Хотя нативные секретируемые экзосомы содержат множественные РНК, включая miRNAs, ncRNAs и фрагменты, но большинство фрагментов маленькие. 75 Крупные молекулы мРНК могут переноситься в экзосомы из эритроцитов с помощью электропортации, но этот процесс неэффективен. 50 В силу этих обстоятельств, Yang et al. представили подход по генерации крупно-масштабных функциональных мРНК-инкапсулировавших экзосом. 76 В этой работе разработан биочип клеточной нанопортации с диаметром частиц в 500 nm. Авт. трансфицировали клетки плазмидной ДНК и стимулировали трансфицированные клетки с помощью локальных и временных электрических стимулов. Эта процедура нанопортации способствует высвобождению экзосом, несущих транскрибируемые мРНК и целенаправленно воздействующих на пептиды из клеток, приводя к более чем 50-кратному увеличению количества экзосом и к более чем 103-кратному увеличению экзосомных мРНК транскриптов, давая больше 2-10 интактных, функциональных мРНК на экзосому.
6 Conclusion and perspectives
Ткане- и клеточно-специфическая доставка генных векторов с помощью разработанных переносчиков делает возможной продвинутую версию генотерапии со снижением токсичности и рисков. Переносчики с клеточной поверхности, экзосомы, могут обеспечивать доставку разных молекул для генотерапии или векторов. В частности, генетические или химические преобразования делают возможной инсталляцию клеточно-специфических последовательностей распознавания на наружную поверхность экзосом, чтобы наводить на цель доставку грузов или экзосомных маркерных белков, это может быть преобразовано, чтобы обогащать белки мишени посредством разработки межбелковых взаимодействий. Помимо преобразований экзосом, наделяющего свойствами связывания нуклеиновых кислот, это также поможет инкапсуляции плазмид или векторов и повысить эффективность загрузки. Слияние экзосом с липосомами будет создавать пузырьки, которые смогут инкапсулировать крупные плазмиды или мРНК транскрипты с сохранением преимуществ экзосом, таких как биосовместимость и способность к целенаправленному действию. В качестве важной ступени в направлении клинических испытаний, будет также достигнут прогресс по реализации крупно-масштабной продукции экзосом или нагруженных лекарствами экзосом. Прорыв в инструментарии и процедурах, такой как нанопортация, также преодолевает узкое горлышко загрузки и продукции. Итак, с улучшением и оптимизацией инструментов редактирования генов, постоянная разработка базирующихся на экзосомах систем переносчиков усилит целенаправленную генотерапию для лечения трудных болезней в будущем
(Fig. 5).
 Fig. 5 Potential future applications of gene therapy. Nucleic acid-based therapeutics can be packaged in Exo-AAVs, or Exo-AAVs engineered with targeting capability can be used for gene delivery into human bodies for gene editing in vivo. Alternatively, the cells isolated from patients can be edited by Exo-AAVs carrying gene-editing tools in vitro and then returned to the patients for disease treatment.
Fig. 5 Potential future applications of gene therapy. Nucleic acid-based therapeutics can be packaged in Exo-AAVs, or Exo-AAVs engineered with targeting capability can be used for gene delivery into human bodies for gene editing in vivo. Alternatively, the cells isolated from patients can be edited by Exo-AAVs carrying gene-editing tools in vitro and then returned to the patients for disease treatment.
|
 Успехи в области генотерапии вселяют надежду на лечение ранее неизлечимых болезней таких как генетические нарушения,3 раковые опухоли,4 и аутоиммунные болезни.5 Кстати, по крайней мере, 943 клинических испытаний генотерапии было осуществлено во всем мире.
Успехи в области генотерапии вселяют надежду на лечение ранее неизлечимых болезней таких как генетические нарушения,3 раковые опухоли,4 и аутоиммунные болезни.5 Кстати, по крайней мере, 943 клинических испытаний генотерапии было осуществлено во всем мире.