Посещений: 
ГЕМАТОПОЭТИЧЕСКИЕ БОЛЕЗНИ
Редактирование генов
Gene Editing of Hematopoietic Stem Cells: Hopes and Hurdles Toward Clinical Translation. Ferrari S, Vavassori V, Canarutto D, et al. Front. Genome Ed. 3:618378. doi: 10.3389/fgeed.2021.618378
| |
|
pattern recognition receptors (PRRs), which sense pathogen-associated molecular patterns (PAMPs
В области гематологии генотерапия, базирующаяся на интегрирующихся векторах, достигла выдающихся результатов для ряда болезней человека. С появлением новых, пригодных для перепрограммирования нуклеаз, таких как CRISPR/Cas9, стало возможным расширить применение генотерапии вне пределов полу-случайного добавления геннов для сайт-специфических модификаций генома, подход, обещающий безопасные генетические манипуляции. Здесь мы рассмотрим состояние ex vivo редактирования генов с помощью программируемых нуклеаз в human hematopoietic stem and progenitor cells (HSPCs).
Генотерапия имеет целью лечение болезней людей путем модификации клеточного генома, напр., замещая дефектный ген или предоставляя новую клеточную функцию. В большинстве случаев генотерапия использует знания о биологии вирусов, чтобы создавать рекомбинантные векторы, способные нести и передавать экзогенную кодирующую кассету в клетки пациента. Достигнут удивительный прогресс в сборе и в манипуляциях с HSPCs, делающий возможной разработку стратегии ex vivo генотерапии, которая позволяет манипуляции с определенными субнаборами клеток, снижая тем самым риск эффектов вне мишени и побочной избыточной токсичности. Ex vivo генотерапия базируется на полу-случайной интеграции retro- (RV) или lenti-viral (LV) векторов, демонстрируя выдающийся потенциал лечения некоторых наследственных и приобретенных гематологических болезней (Ghosh et al., 2015; Naldini, 2019). С этой целью аутологические HSPCs выделяются, трансдуцируются in vitro с помощью вирусных векторов и в конечном итоге обратно вводятся пациенту. Стабилизирующий режим обычно применяется перед введением, чтобы истощить клетки хозяина и усилить максимально приживление преобразованного продукта (Bernardo and Aiuti, 2016). Открытие и перепрофилирование программируемых молекул, таких как нуклеазы, редактирование оснований и prime editors открыли дорогу lklz целенаправленного редактирования генов, т.e., делеции, инсерции и замены сайт-специфических нуклеотидов или интеграция кассеты с терапевтическим трансгеном в предопределенный геномный локус (Doudna, 2020). Эти новые технологии могут быть использованы для доставки широкого спектра генетических манипуляций с потенциалом пригодности для некоторых гематологических болезней. В самом деле, целенаправленное редактирование генома с помощью программируемых нуклеаз уже используется в клинике и сегодня они тестируются с обнадеживающими результатами (Xu et al., 2019; Frangoul et al., 2021).
Согласно Ferrari et al. HSC Gene Editing for Hematological Diseases редактирования генов всё ещё находится в зачаточном состоянии и пробелы в нашем знании и технологии продолжают заполняться, чтобы использовать их в клинике. Более того, безопасность и эффективность при кратковременном и долговременном воздействии всё ещё неизвестны.
FPROGRAMMABLE NUCLEASES FOR TARGETED GENOME EDITING
Программируемые нуклеазы являются химерными молекулами, состоящими из (i) базирующихся на белок- или РНК структурах, связывающих ДНК, которые предопределяют специфичность нуклеаз, и (ii) эффекторном домене с каталитической нуклеазной активностью , которая вызывает разрывы двойной нити ДНК (DSB) рядом или внутри сайта связывания. Zinc Finger Nucleases (ZFNs), Transcription Activator-Like Effector Nucleases (TALENs) и Clustered Regularly Interspaced Short Palindromic Repeats (CRISPR)/Cas системы являются наиболее используемыми нуклеазными платформами для целенаправлденного редактирования генов (Carroll, 2014). ZFNs состоят из 3-6 zinc-finger (ZF) ДНК связывающих доменов, сцепленных с помощью гибких пептидных линкеров с неспецифическим FokI расщепляющим доменом. Каждый ZF домен состоит из 30 аминокислот и распознает нуклеотидные триплеты в главной борозде двойной спирали ДНК; в целом каждый ZFN распознает 9-18 нуклеотидов (Gaj et al., 2013). Последовательности и структура упомянутых выше гибких пептидных линкеров является фyндаментом для достижения эффективного разрезания и специфического воздействия на мишень (Handel and Cathomen, 2011). Механистически пара ZFN мономеров д. связывать ДНК, обычно в конфигурации голова-к-голове, за счет ассоциации с нитями ДНК противоположной полярности и приводить к пробелу в 5-7 bp. Это приводит к димеризации двух FokI доменов, которые катализируют DSB ДНК (Urnov et al., 2010). TALENs состоят из домена, представленного модулярными TALE повторами, слитыми с FokI нуклеазным доменом. Каждый TALE повтор состоит из 33-35 аминокислот и распознает одиночный нуклеотид; специфичность определяется двумя гиперизменчивыми остатками, известными как Repeated Variable Diresidues (RVDs) (Gaj et al., 2013). В самом деле, TALE повторы могут быть собраны вместе довольно простым способом, чтобы спариваться с желаемой последовательностью ДНК, нуклеотид к нуклеотиду. Как и в случае с ZFNs, пара TALEN мономеров необходима для индукции DSB.
Наконец, CRISPR/Cas является базирующейся на РНК системой целенаправленного воздействия на ДНК, найденной в бактериях в качестве приобретенной иммунной системы против передаваемых генетических элементов, таких как вирусы и плазмиды (Barrangou et al., 2007; Brouns et al., 2008; Garneau et al., 2010). Streptococcus pyogenes (Sp) Cas9 белок (SpCas9) (Nozawa et al., 2011), принадлежащий к type II семейству CRISPR/Cas систем, является наиболее широко используемой платформой для CRISPR-based целенаправленного редактирования генов. Механистически CRISPR/Cas9 система состоит из однонитчатой гид РНК (sgRNA) и Cas9 эндонуклеазы, фермента, необходимого для обеспечения целенаправленного расщепления ДНК. sgRNA содержит уникальную в 20 пар оснований последовательность, комплементарную сайту ДНК мишени и может легко искусственно изменена, чтобы связывать желательную геномную последовательность путем спаривания оснований Watson-Crick (Jinek et al., 2012). Присутствие protospacer adjacent motif (PAM), непосредственно ниже сайта ДНК мишени, необходимо для эффективного связывания и развязывания ДНК, напр., 5' -NGG-3' с помощью SpCas9, хотя некоторая активность разрезания присуща также и 5' -NAG-3' мотиву (Hsu et al., 2013; Sternberg et al., 2014). Все эти платформы обладают прирожденными преимуществами и недостатками (Gaj et al., 2013). TALENs легко собирается в произвольные крупные массивы, чтобы связывать интересующие последовательности, но их прирожденная повторяемость и крупные размеры затрудняют эффективное клонирование и ограничивают доставку с помощью вирусных векторов. ZFNs значительно меньше в размере и легче их клонировать, но труднее изготовить и оптимизировать, благодаря отсутствию строгого кода распознавания и взаимозависимости каждого модуля с окружением. Оба инструмента имеют ограниченные пределы последовательностей ДНК мишеней, т.к. ZFNs предпочитают богатые G последовательности (Isalan, 2012), а TALENs обычно связывают сайты с низким содержанием G, строго начинающиеся с T основания (Bogdanove and Voytas, 2011). Система CRISPR/Cas9 более гибкая и целенаправленная, легче и быстрее приготовляется и синтезирует sgRNA, комплементарную интересующим последовательностям. Множественные последовательности м. одновременно под целенаправденно воздействовать и не требуется белковой оптимизации. Популярность CRISPR/Cas технологии быстро превзошла ZFNs и TALENs. CRISPR/Cas9 также несвободна от ограничений, главным является распределение PAM последовательностей, которые ограничивают набор подвергаемых воздействию последовательностей. В самом деле, были предприняты громадные усилия по расширению репертуара потенциальных мишеней. Cas9 гомологи (напр., Cas12a/Cpf1) (Zetsche et al., 2015a) и Cas9 белки, требующие разных последовательностей PAM, были идентифицированы у др. видов бактерий (Ran et al., 2015; Xu et al., 2015; Lee et al., 2016; Mьller et al., 2016); Cas9 со смягченными PAM предпочтениями (Cas-NG и xCas) (Hu et al., 2018; Nishimasu et al., 2018) или с нешаблонными PAM профилями (SpCas9-VQR, VRQR и VRER) (Kleinstiver et al., 2015, 2016) были разработаны с помощью направленной эволюции или целевых преобразований структуры. Недавно вариант SpCas9 (SpRY), требующий 5' -NRN-3' PAM, был cгенерирован, чтобы редактировать ранее недоступные генетические сайты, это позволяет преодолевать большинство связанных с PAM ограничений (Walton et al., 2020). Кстати, мало данных получено для первичных типов клеток крови с помощью упомянутых инструментов (Wang et al., 2017; Xiao et al., 2019), необходимых для лечения гематологических болезней.
THERAPEUTIC OPPORTUNITIES FOR TARGETED GENOME EDITING IN HSPCs
Индукция единичных или множественных DSB(s) ДНК с помощью программируемых нуклеаз запускает DNA damage response (DDR), которые вызывают репарацию ДНК и в конечном итоге предопределяют судьбу клеток. Репарация DSB ДНК в основном происходит с помощью non-homologous end joining (NHEJ) пути или homology-directed repair (HDR) пути (Chapman et al., 2012), альтернативные пути также описаны (Yeh et al., 2019). Система NHEJ сшивает разорванные концы ДНК способом, склонным к ошибкам, напр., в статье 618378 Ferrari et al. HSC Gene Editing for Hematological Diseases наблюдаются случайные делеции и инсерции оснований (indels). Путь HDR использует гомологичную ДНК матрицу, подобно сестринской хроматиде, чтобы верно репарировать разрывы ДНК. NHEJ активна в течение всего клеточного цикла, HDR ограничивается фазами S/G2 (Branzei and Foiani, 2008; Heyer et al., 2010). Оба типа репарации используются для терапевтических целей при HSPCs (Figure 1). Базирующееся на NHEJ геномное редактирование используется в следующих случаях: (i) целенаправленный нокаут гена: NHEJ-обусловленные indels, нацеленные на кодирующую последовательность могут приводить к мутациям сдвига рамки считывания и генерации преждевременных стоп-кодонов, которые могут вызывать целенаправленное нарушение функции гена. Эта стратегия может быть использована для замалчивания патогенного гена или индукции резистентности против патогена путем нокаута генов, это облегчает инфекцию, напр., разрушение CCR5 открывает рамку считывания в гематопоэтических клетках, вызывая тем самым резистентность к инфекции HIV (Wang and Cannon, 2016; Xu et al., 2019); (ii) восстановление откорректированной рамки считывания: NHEJ-обусловленные indels могут быть использованы для восстановления нормальной рамки считывания гена и тем самым корректировать мутации сдвига рамки считывания. Такая стратегия вполне походит для коррекции некоторых мутаций, вызывающих болезнь Fanconi Anemia, в гене FANCA при HSPCs (RomбnRodrнguez et al., 2019); (iii) целенаправленное внесение делеции: программируемые нуклеазы могут быть использованы для создания двух DBSs фланкирующих интересующий регион, это приводит к эксцизии и делеции пробела, репарируемого с помощью NHEJ (Lee et al., 2010). Эта стратегия может использоваться для удаления одного или нескольких патогенных экзонов, чтобы пресечь доминантную экспансию триплета или делетировать регуляторный регион, который контролирует экспрессию белка. Делеция эритроид-специфичного энхансера BCL11A (Bauer et al., 2013), репрессора транскрипции, который ингибирует экспрессию плодного гемоглобина (Hb-F), это может повысить уровень Hb-F, приводя к ослаблению болезненного проявления sickle cell disease (SCD) и β-thalassemia. HDR-обусловленное геномное редактирование нуждается в добавлении донорской матричной ДНК, добавляя гомологичную последовательность к сайту мишени для нуклеазы и это может быть использовано в следующих случаях: (i) целенаправленной коррекции точковых мутаций: доставка нуклеазы, которая расщепляет вблизи сайта мутации, и донорской матрицы, содержащей последовательность дикого типа (Urnov et al., 2005), это пригодно для коррекции мутаций одиночных нуклеотидов. Этот подход может быть пригоден для SCD, которая вызывается заменой одиночной аминокислоты (Glu на Val) в 6-ой позиции гена HBB (Dever et al., 2016; DeWitt et al., 2016; Park et al., 2019; Pattabhi et al., 2019; Romero et al., 2019), и для X-сцепленной chronic granulomatous disease (CGD), часто вызываемой мутациями в гене CYBB (De Ravin et al., 2017, 2021); (ii) при in situ коррекции гена с помощью целенаправленной инсерции cDNA: многие моногенные болезни не вызываются с помощью повторяющейся мутации одиночного нуклеотида, а скорее разными мутациями одного и того же гена. Интеграция функциональной cDNA, покрывающей горячие точки мутаций, в намеченном регионе гена мишени (напр., эндогенный стартовый кодон, интронный регион), может одновременно влиять на все нижестоящие мутации (Voit et al., 2014). Проверка принципа этого подхода была осуществлена для некоторых гематологических болезней, включая X-linked severe combined immunodeficiency (SCID-X1) (Schiroli et al., 2017; Pavel-Dinu et al., 2019), CGD (Sweeney et al., 2017), Hyper-IgM 1 syndrome (Hubbard et al., 2016; Kuo et al., 2018; Vavassori et al., 2021) и Wiskott-Aldrich syndrome (WAS) (Rai et al., 2020); (iii) целенаправленное добавление гена в безопасный локус гавань: интеграция терапевтической кассеты в специфический регион генома может представлять собой ценную стратегию при постоянной избыточной экспрессии трансгена, необходимой для получения терапевтического эффекта (Moehle et al., 2007). Наилучшими местами для добавления гена в геном являются безопасные гавани (safe harbors), рассматриваемые как геномные места, которые толерантны к гомозиготной инактивации гена, поддерживают мощную экспрессию трансгена и устойчивы к интеграции трансгена и их регуляторные элементы не подвержены каким-либо побочным эффектам, таким как злокачественное перерождение или изменения клеточной функции (Sadelain et al., 2012). Одним из типичных применений является целенаправленная интеграция откорректированного gp91phox трансгена в локус AAVS1 для лечения CGD (De Ravin et al., 2016); (iv) экспрессия трансгена может использовать эндогенные регуляторные элементы: контроль экспрессии трансгена с помощью эндогенных регуляторных элементов может обеспечивать высокую, мощную и клеточно-специфическую экспрессию белков. Примерами являются α-L-iduronidase (Hurler syndrome, OMIM #607014), α-galactosidase (Fabry disease, OMIM #301500), lysosomal acid lipase (Wolman disease, OMIM #278000) и factor IX (Hemophilia B, OMIM #306900), которые находятся под транскрипционным контролем эндогенного α-globin промотора, обеспечивая эритроид-специфическую экспрессию (Pavani et al., 2020).
CHALLENGES AND ADVANCES TOWARD CLINICAL APPLICATION OF HSPC GENE EDITING
Предварительные результаты обнадеживают, что возможен перенос в клинику редактирования генов при HSPC нарушениях крови, д. быть решен ряд вопросов относительно источника и культивирования клеток, доставки нуклеаз и корректирующей матрицы, нуклеазной активности и эффективности коррекции гена, особенно при долговременной репопуляции фракции HSC. В зависимости от течения болезни каждый из этих аспектов д. быть всесторонне учтен в отношении оценки риска и благоприятного эффекта терапевтической стратегии. Несколько исследований в последние годы были сконцентрированы на оптимизации протокола редактирования генов и разработке новых инструментов и стратегий, чтобы максимально усилить эффективность редактирования генов и специфичность для надежного и успешного улучшения. Разработка ex vivo Cell Culture Conditions Cell culture протоколов д. найти четкий баланс между вседозволенностью манипуляций редактирования генов, клеточной экспансией и поддержанием потенциала стволовости (Figure 2). Тонкое контролирование условий культивирования и времени редактирования анализируются, чтобы способствовать прогрессии клеточного цикла HSPC и активации и достижению устойчивого редактирования, а также долговременному сохранению преобразованных клеток. В самом деле, HDR-обеспечиваемое редактирования генов ограничивается медленным циклом делений и неактивностью примитивных HSCs. В целом уровень экспрессии аппарата репарации ДНК коррелирует с активностью клеточной пролиферации и стволовостью; следовательно, долговременное восполнение HSCs обнаруживает более низкую активность в отношении HDR, чем детерминированные предшественники (Beerman et al., 2014; Biechonski et al., 2018; Schiroli et al., 2019).
Ex vivo Ferrari et al. HSC Gene Editing for Hematological Diseases
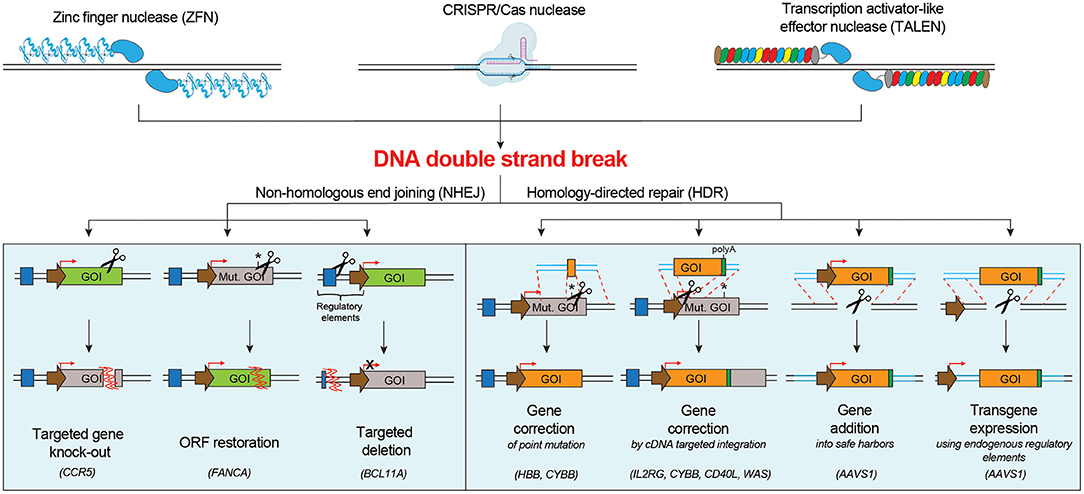
FIGURE 1 | Schematic of the main DNA double strand break repair mechanisms in human cells and their possible applications for targeted genome editing. NHEJ pathway engagement may be exploited for knocking-out a gene, correcting a gene by restoring its open reading frame (ORF), inserting a targeted deletion. HDR pathway engagement may be exploited for gene correction of point or multiple mutations, gene addition in a safe harbor locus or targeted transgene expression using endogenous regulatory elements. Mut. GOI, Mutated Gene Of Interest. culture of HSPCs for 48 or 72 h before editing, in presence of cytokine mixtures containing at least SCF, FLT-3L, and TPO (Walasek et al., 2012), pushes repopulating cells to exit from quiescence and transit through S/G2 phases, thus increasing HDR efficiency (Genovese et al., 2014; Zonari et al., 2017; Bak et al., 2018). However, prolonged culture times lead to cell differentiation and multipotency loss.
Добавление в культуральную среду соединений, поддерживающих стволовость, таких как Stem Regenin-1 (Boitano et al., 2010), UM171 (Fares et al., 2014) и 16,16-dimethyl prostaglandin E2 (dmPGE2) (Hoggatt et al., 2009), помогает поддерживать длительное время способность к возобновлению многоклональной популяции отредактированных человеческих HSPCs, трансплантированных мышам, моделирующим иммунодефицит, это частично покрывало недостатки продолжительного культивирования (Charlesworth et al., 2018; Ferrari et al., 2020).
Delivery Vehicles for Programmable Nucleases and DNA Template for HDR-Mediated Editing
Было тестировано несколько платформ по доставке программируемых нуклеаз и HDR матриц в гематопоэтических клетках с целью максимально усилить эффективность редактирования генов и минимализировать токсичность воздействия. Проверка концепции для in vitro HDR-обеспечиваемой интеграции была осуществлена путем доставки как нуклеаз, так и донорской кассеты с помощью вирусных векторов в HSPCs человека (Lombardo et al., 2007). Позднее электропортация стала предпочтительным методом для эффективной доставки программируемых нуклеаз в ex vivo культивируемых HSPCs (Genovese et al., 2014). In vitro транскрибируемые мРНК, кодирующие нуклеазы (Genovese et al., 2014; Wang et al., 2015; Schiroli et al., 2017) или рибонуклеопротеин (RNP), собирали вместе с рекомбинантным белком Cas и sgRNA (Hendel et al., 2015; Dever et al., 2016) и это стало золотым стандартом по достижению высокой, но временной нуклеазной активности в HSPCs и др. клетках мишенях (Hubbard et al., 2016; Eyquem et al., 2017). Трансдукция с помощью вирусных векторов в виде integrase-defective LVs (IDLVs) или adeno-associated vectors serotype 6 (AAV6) (Genovese et al., 2014; Wang et al., 2015; Dever et al., 2016; Schiroli et al., 2017; Kuo et al., 2018; Pavel-Dinu et al., 2019; Rai et al., 2020), также как и электропортация одно-нитчатых модифицированных с помощью phosphorothioate олигодеоксинуклеотидов (ssODNs) (DeWitt et al., 2016; De Ravin et al., 2017, 2021; Park et al., 2019; Pattabhi et al., 2019; Romero et al., 2019), оказались устройствами, предпочитаемыми сегодня для доставки ДНК матрицы при HDR в HSPCs. В целом, эти платформы обеспечивают широкий спектр грузов и могут быть пригодны для разных стратегий редактирования генов. Короткие ssODN ограничены по длине и могут быть использованы для in situ коррекции генов с небольшими мутациями, вызывающими болезни. Напротив, AAV6 и IDLV могут нести более крупные грузы (примерно более 4.7 и 8 kb, соотв.), они пригодны для целенаправленной интеграции длинных терапевтических кассет. Однако, аденовирусные векторы и не вирусные устройства, такие как плазмиды и двунитчатые ДНК матрицы, имеют ограниченное применение в первичных гематопоэтических клетках из-за низкой эффективности и переносимости, хотя имеются определенные исключения (Roth et al., 2018).
Maximizing HDR Editing Efficiency
Абсолютные и относительные количества клеток, которые необходимы для редактирования, зависит от болезни и терапевтической стратегии. Напр., как в случае отсутствия IL2RG, которое является летальным для развивающихся лимфоцитов, строгие селективные преимущества предшественников функциональных Т клеток по сравнению с дефектными могут быть приняты для относительно низкой эффективности, а менее 10% функциональных HSPCs, как полагают, вполне достаточно для восстановления от SCID-X1 фенотипа (Schiroli et al., 2017). Напротив, минимальная пропорция отредактированных клеток д. быть существенно выше для полного устранения патологических проявлений у пациентов с др. нарушениями крови, такими как гемоглобинопатии или Hyper-IgM1 (Abraham et al., 2017; Marktel et al., 2019; Vavassori et al., 2021; Wilkinson et al., 2021). В самом деле, субоптимальная эффективность редактирования генов при HDR остается основным препятствием по широкому использованию этой технологии, по сравнению с высокой эффективностью NHEJ-обеспечиваемого редактирования генов (Humbert et al., 2019; Frangoul et al., 2021).
В первых исследованиях по редактирования генов на человеческих HSPCs, IDLV трансдукция комбинировалась с электропортацией ZFNs мРНК, что приводило к 5-10% HDR редактированию в большей части CD34+ популяции и к 2-5% в примитивной CD34+CD133+CD90+ фракции HSPC, которая содержит клетки со способностью к долговременному приживлению у иммунодефицитных мышей (Genovese et al., 2014). Однако, переключение на AAV6 векторы для HDR доставки матричной ДНК позволило увеличить в 5 раз эффективность HDR редактирования в примитивных HSPCs по сравнению с базирующимся на IDLV протоколом, независимо от используемой нуклеазной платформы (Wang et al., 2015; Dever et al., 2016; Schiroli et al., 2017; Kuo et al., 2018; Pavel-Dinu et al., 2019; Rai et al., 2020). Конечно, IDLV трансдукция в присутствии cyclosporin H повышает эффективность HDR до 15-20% в долговременном потомстве трансплантированных человеческих HSPCs с помощью высвобождения от interferon-induced transmembrane protein 3 (IFTM3), вызывающего ограничение проникновения (Petrillo et al., 2018; Soldi et al., 2020), тем самым подтверждается, что общий груз ДНК в ядрах трансдуцированных клеток всё ещё является ограничивающей ступенью по использованию HDR. Однако, др. молекулярные механизмы, усиливающие эффективность HDR при использовании AAV6 всё ещё остаются до конца неясными. Внесение HDR факторов с помощью AAV инвертированных терминальных повторов (Hirsch, 2015) и использование альтернативных путей по применению одно-нитчатых матриц для репарации ДНК DSB могут вносить вклад в повышение редактирования генов с помощью HDR (Yeh et al., 2019). Безусловно, ssODNs делают возможной эффективную коррекцию генов, сходной с таковой, что наблюдается при использовании AAV6 в долговременных примитивных HSPCs после ксенотрансплантации (De Ravin et al., 2017; Pattabhi et al., 2019; Romero et al., 2019). ssODNs , скорее всего, задействуют механизмы репарации DSB ДНК, отличные от IDLV и возможно AAV6, предпочитая single-stranded template repair (SSTR) путь скорее, чем обычный HDR (Richardson et al., 2018).
Несмотря на эти существенные шаги вперед, эффективность редактирования HDR для некоторых приложений все еще ограничена. Было предложено несколько стратегий для повышения эффективности HDR в клетках млекопитающих путем временного изменения путей репарации ДНК или статуса клеточного цикла. Подавление NHEJ с помощью малых молекул или белков, small molecules or proteins, связывание HDR-способствующих факторов с Cas9 нуклеазой или синхронизация S/G2 клеточного цикла, способствуют использованию HDR в ответ на нуклеазой вызванные DSB ДНК в клеточных линиях и плюрипотентных клетках (Chu et al., 2015; Maruyama et al., 2015; Gutschner et al., 2016; Charpentier et al., 2018; Jayavaradhan et al., 2019). Однако, эффективность этих подходов в долговременных возобновляющихся (repopulating) HSCs ограничена (Kuo et al., 2018; De Ravin et al., 2021) или не доказана. Недавно сообщалось о стимулировании прогрессирования клеточного цикла либо путем поддержания низкой концентрации клеток во время манипуляций ex vivo (Charlesworth et al., 2018), либо с помощью модуляторов клеточного цикла (Ferrari et al., 2020; Shin et al., 2020). как наиболее эффективной стратегия для улучшения HDR-редактирования в HSC человека с долгосрочной репопуляцией.
Обогащение клеток, подвергающихся предполагаемой модификации генома, может быть альтернативной (или даже дополнительной) стратегией увеличения доли, но не количества отредактированных клеток в трансплантате и уменьшения конкуренции с неотредактированным аналогом. Генную коррекцию можно сортировать по отредактированным клеткам, используя эндогенные маркеры, экспрессируемые на клеточной мембране. В качестве парадигматического примера, выбор HSPC, редактируемых по HBB, был достигнут путем встраивания кассеты репортера в шаблон HDR, достигая до 90% HDR отредактированных клеток в долговременном трансплантате (Dever et al., 2016). В другом исследовании одновременное редактирование интересующего локуса и неродственного гена, обеспечивающего лекарственную устойчивость к химическим соединениям, позволило эффективно обогащать редактируемые человеком HSPC в условиях отсутствия маркеров. (Agudelo et al., 2017).
Tolerability of the Gene Editing Procedure
Чтобы противостоять постоянной угрозе агентов, повреждающих ДНК, клетки разработали набор механизмов восстановления, а также пути старения и запрограммированной гибели клеток. В самом деле, как DSB, так и доставка экзогенных донорских матриц, используемых в качестве инструмента для редактирования генов, могут запускать сложные клеточные реакции, в принципе приводящие к вредным исходам (Figure 2). Однако, последствия редактирования генов на клеточную жизнеспособность, а также осуществление NHEJ/HDR, может варьировать между разными типами клеток и строго зависит от клеточной биологии. Сходным образом, благодаря их фундаментальной роли в гомеостазе крови, человеческие HSPCs оказываются эволюционно более чувствительными, чем клеточные линии и др. типы клеток к экстенсивным воздействиям; поэтому процедуры редактирования генов должны быть существенно адаптированы для обеспечения максимальной переносимости.
В качестве первой линии защиты хозяина иммунные клетки человека обнаруживают рецепторы распознавания паттернов (PRR), которые воспринимают ассоциированные с патогеном молекулярные структуры (PAMP), такие как экзогенные нуклеиновые кислоты, и способствуют высвобождению интерферонов типа I (IFN) и других цитокинов. (Piras and Kajaste-Rudnitski, 2020). Активация PRRs в HSPCs и избыточная экспрессия IFN-стимулированных генов (ISGs) могут индуцировать разные исходы, включая выход из состояния покоя, дифференцировку и апоптоз (Essers et al., 2009; Sato et al., 2009; Liu et al., 2012). In vitro транскрибированные 5'-triphosphate sgRNAs и мРНК, кодирующие нуклеазы, могут сильно активировать ISGs посредством PRRs, снижая клеточную жизнеспособность и клоногенный потенциал (Mu et al., 2019). Ослабление этих реакций посредством переключения на химически синтезируемые sgRNAs или на с помощью high-pressure liquid chromatography (HPLC)-очищенные мРНК с включенными аналогами оснований (Hendel et al., 2015; Schiroli et al., 2017). Более того, электропортация CRISPR/Cas9 аппарата в виде RNP, скорее, чем мРНК, оказывается более скрытной в HSPCs людей (Cromer et al., 2018). Конечно, IFN индукция может также затрагивать сопутствующую вирусную трансдукцию, ограничивая тем самым доставку HDR матрицы некоторыми векторами (Petrillo et al., 2018). Более того, вторичные структуры или гибриды нуклеиновых кислот, присутствующие в геномах вирусных векторов могут быть распознаны хозяином и вызвать временные клеточные реакции (Piras and Kajaste-Rudnitski, 2020).
Клеточные сенсоры активируются не только присутствием экзогенных белков и нуклеиновой кислоты, но и повреждением ДНК, вызванным их действием. Токсичность нуклеаз, обусловленная p53, наблюдается в: (i) induced pluripotent stem cells (iPSCs) (Ihry et al., 2018) и линиях клеток (Haapaniemi et al., 2018; Enache et al., 2020), приводя к апоптозу или аресту клеточного цикла; (ii) HSPCs с удивительным воздействием на клоногенную способность (Schiroli et al., 2019). Соотв., множественные DSBs приводят к более высокой зависимой от p53 DDR в HSPCs, вплоть до становления способствующих воспалению программ транскрипции с соотв. более высоким влиянием на клоногенный потеницал (Schiroli et al., 2019).
Доставка матриц, обеспечиваемая с помощью AAV6 и IDLV, ощущается HSPCs (Piras et al., 2017; Schiroli et al., 2019). В частности, AAV6 трансдукция per se запускает мощные реакции p53, которые накапливаются вместе с одновременным воздействием на нуклеазы. Эти конвергентные импульсы приводят к существенному снижению пролиферации HSPC, сжатию размера человеческого трансплантата и олигоклональному его восстановлению отредактированными клетками после ксенотрансплантации иммунодефицитным мышам (Ferrari et al., 2020). Молекулярный каскад, приводящий к активации p53, выяснен не до конца. Интересно, что временное подавление p53 ограничивается первыми 24 ч процесса редактирования генов, усиливая переносимость процедуры и восстановление поликлональной композиции человеческого трансплантата, сохраняя мультиклональный потенциал HSPC (Schiroli et al., 2019; Ferrari et al., 2020). Более того, подавление p53 теоретически может смягчать риск увеличения пропорции p53-/- мутантных клонов с высоким онкогенным потенциалом, который обычно редок в популяции HSPC от здоровых доноров, но может стать более частым у пациентов с специфическими генетическими болезнями, такими как анемия Fanconi или Diamond-Blackfan анемия (Lipton and Ellis, 2009; Ceccaldi et al., 2011). Из-за временного подавления p53 возникает теоретическое беспокойство по поводу ненадлежащего спасения клеток с хромосомными аберрациями и высокой мутационной нагрузкой, не сообщалось также об увеличении мутационной нагрузки из-за её неполного и временного ингибирования (Garaycoechea et al., 2018; Schiroli et al., 2019). Более того, даже если возникают некоторые редкие генотоксические события, подталкивающие к восстановлению пути p53, то можно ожидать, что они будут отбирать клетки, которые приобрели их, до появления последующих попаданий, необходимых для онкогенной трансформации. (Di Micco et al., 2006; Bondar and Medzhitov, 2010).
Напротив использование ssODN вместо вирусных векторов в качестве HDR матрицы не вызывает куммулятивно активацию p53 и хорошо переносится HSPCs, не оказывая влияния на их способность к репопуляции (Pattabhi et al., 2019; Romero et al., 2019).
Assessment of Editing Genotoxicity and Optimization of Nuclease Specificity
Специфичность программируемых нуклеаз предопределяется соотношением между воздействием на мишень и вне мишени, т.e., частота DSB ДНК в намеченном сайте мишени и в непредусмотренных геномных локусах. Хотя редактирования геномов предлагает более высокий уровень специфичности, чем платформы генетических преобразований, базирующиеся на полу-случайной интеграции векторов, генерация вне мишени DSBs ДНК может оказаться главным источником генотоксичности. Активность нуклеаз вне мишени может иметь и не биологические последствия, вместо того, чтобы быть цитотоксичной, нокаут супрессирующих опухоли генов вызывает включение вне мишени донорской ДНК или вызывает хромосомные перестройки. Его нагрузка может варьировать в зависимости от нуклеазной платформы, донорской ДНК и целевой последовательности ДНК. Более того, непредусмотренные события вне мишени, такие как эксцизии или инсерции случайных фрагментов ДНК, были описаны после редактирования генов в не гематопоэтических типах клеток (Kosicki et al., 2018; Hanlon et al., 2019; Nelson et al., 2019). Последствия непредусмотренных событий в мишени и вне мишени, как полагают, отличаются в зависимости от стратегии редактирования в целом и проявлений заболевания и, следовательно, требуют индивидуальной оценки . Более того, события вне мишени предположительно более переносимы в полностью дифференцированных и коротко-живущих типах клеток. Следовательно, тщательная оценка специфичности нуклеазы является обязательной при стремлении к клиническому использованию сконструированных HSPC, потому что эти клетки должны будут поддерживать кроветворение в течение всей жизни, выполняя несколько циклов самообновления и дифференцировки у пациента.
С учетом того, что программируемые нуклеазы работают и работают, тщательное обнаружение нецелевой активности требует разработки инновационных и специальных инструментов. Для этой цели используется панель алгоритмов прогнозирования in silico (Haeussler et al., 2016; Labun et al., 2019), а также in vitro (например, DIGENOME-seq, CIRCLE-seq) (Kim et al., 2015; Tsai et al., 2017) и в анализах целлюлозы (например, отлов IDLV, GUIDE-seq) (Gabriel et al., 2011; Tsai et al., 2015). Все эти методы обнаруживают существенную чувствительность и специфичность и ни один из них сам по себе не позволяет осуществить тщательную и точную идентификацию нуклеаз, действующих вне мишени, т.к. не существует золотого стандарта. В самом деле, биоинформационные инструменты и анализы in vitro обычно выдают большое количество предполагаемых нецелевых сайтов, но многие из них не перекрываются с теми, которые были обнаружены в анализах целлюлозы или подтверждены целевым секвенированием следующего поколения (NGS). Комбинация более чем одного анализа, как правило, рекомендуется для сбора более широкой панели предполагаемых нецелевых сайтов, которые затем могут быть проверены с помощью целевых NGS в интересующем типе клеток. С другой стороны, остается спорным, следует ли рассматривать участки, не являющиеся мишенями для нуклеазы, выявленные в тестах in silico или in vitro, но не подтвержденные в анализах целлюлозы или во время фазы проверки, как ложноположительные события. Предел обнаружения NGS (0,1-0,01%), вероятно, является основным ограничением для комплексной оценки нецелевой нуклеазной активности с точки зрения клинического использования. Например, до 105 клеток в лекарственном препарате могут иметь неизмеримую нуклеазную активность на нецелевом участке, учитывая дозу отредактированных HSPC, обычно вводимых в условиях генной терапии (from 107 to 109) (Gaspar et al., 2011; Sessa et al., 2016; Eichler et al., 2017; Thompson et al., 2018; Ferrua et al., 2019; Marktel et al., 2019; Esrick et al., 2021).Кроме того, анализы специфичности обычно не принимают во внимание широкий спектр геномного полиморфизма в человеческой популяции, что, вероятно, исключает потенциально важные индивидуальные и специфичные для популяции сайты вне мишени. Специальные анализы для строгой и всесторонней оценки профиля генотоксичности программируемых нуклеаз, помимо нецелевых событий, в настоящее время отсутствуют и будут актуальны для решения любых проблем безопасности на доклинической стадии. Несмотря на то, что в настоящее время не существует никаких руководящих указаний, следует строго контролировать ранее подтвержденные непреднамеренные события, связанные с целевыми и нецелевыми событиями, после введения пациентам, аналогично анализу участков продольной интеграции, которые считаются стандартом в текущих клинических протоколах добавления генов. (Aiuti et al., 2013; Thompson et al., 2018).
Активность вне мишени зависит: (i) гомологии последовательностей между сайтом мишени и сайтами вне мишени; (ii) the сродства ДНК к нуклеазе; (iii) продолжительности экспозиции. Чтобы минимизировать события вне мишени, предложено несколько стратегий, усиливающие два последних аспекта, также как и скрининг sgRNA для идентификации этих предсказуемых тех из них, которые более точны для нацеливания на предполагаемый регион. Действительно, пролонгированная нуклеазная активность и высокая концентрация нуклеаз снижают специфичность редактирования (Hsu et al., 2013; Pattanayak et al., 2013; Kim et al., 2014; Shapiro et al., 2020), которая вместо этого может быть улучшена с помощью экспрессии временной нуклеазы, например, посредством мРНК или РНП (Dever et al., 2016) или с использованием расщепленных или индуцибельных Cas9 мутантов (Davis et al., 2015; Nihongaki et al., 2015; Zetsche et al., 2015b).
В последние годы, активные преобразования улучшили специфичность и эффективность CRISPR/Cas9 путем модификации архитектуры sgRNA и Cas9. Использование 5'-укороченных sgRNAs (tru-gRNA) привело к сходной активности в мишени, но в несколько раз меньшей активности вне мишени (Fu et al., 2014), скорее всего, за счет уменьшения энергии взаимодействия на уровне РНК-ДНК гетеродуплекса (Lim et al., 2016). Добавление двух гуанинов на 5' конце sgRNA также снижало активность вне мишени, хотя одновременно снижало активность редактирования в мишени в некоторых случаях (Cho et al., 2014). Далее химические модификации (2'-O-methyl-3'phosphorothiorate or 2'-O-methyl-3' thiophosphonoacetate) трех терминальных нуклеотидов на 5' и 3' концах улучшали профиль специфичности и усиливали переносимость по сравнению с не модифицированными sgRNA в гематопоэтических клетках (Hendel et al., 2015). Касательно Cas9, были идентифицированы новые варианты [eSpCas9(1.1) и SpCas9-HF1] с более высокой точностью в результате ослабления силы взаимодействия с ДНК (Kleinstiver et al., 2016; Slaymaker et al., 2016), путем мутагенеза, нацеленного на структуру. Однако, эти варианты обнаруживали более низкую активность в в мишенях, чем дикого типа SpCas9 в HSPCs человека, если доставлялись в виде RNP (DeWitt et al., 2016; Vakulskas et al., 2018). Недавно, др. очень специфичные варианты SpCas9, такие как EvoCas9 (Casini et al., 2018), SniperCas9 (Lee et al., 2018) и HiFi-Cas9 (Vakulskas et al., 2018) были открыты с помощью направленных эволюционных подходов. Позднее были продемонстрированы с улучшенной точностью и scjrbv уровнем редактирования генов в мишени по сравнению с дикого типа SpCas9 в HSPCs людей. Сходные подходы были также осуществлены и для др. инструментов редактирования генов, включая ZFNs и TALENs (Miller et al., 2007; Hubbard et al., 2015).
Хотя подробный анализ и рассмотрение специфичности нуклеаз являются обязательными, наличие некоторых нежелательных геномных событий не обязательно препятствует редактированию генов при переходе к безопасному клиническому использованию. Меры предосторожности требуют, чтобы усилия были направлены на минимизацию их частоты, но их фактические последствия могут зависеть от конкретного контекста. Нежелательные геномные события могут теоретически вносить вклад в возникновение рака, в зависимости от их расположения в геноме и их природы. Однако, поскольку онкогенная трансформация является многогранной и многоступенчатой, одни и те же мутации могут вызывать или не вызывать опухоли, в зависимости от генетического фона и последующего воздействия других генотоксических явлений. Для справки: патогенные мутации могут оставаться незамеченными в течение многих лет и приводить к явному заболеванию у небольшой части людей, перенесших очередной "удар" по геному. (Greaves, 2018). Более того, здоровые люди могут иметь клональный гематопоэз из-за онкогенных мутаций, которые могут сохраняться годами без доказательств патогенности, несмотря на повышение риска злокачественной трансформации (Takahashi et al., 2017; Zink et al., 2017). Напротив, в условиях болезни, когда клональная экспансия отредактированных клеток уже запускается сильным селективным преимуществом, предоставляемым генной коррекцией, те же генотоксические события могут способствовать онкогенной трансформации.
Manufacturing for Therapeutic Gene Editing Protocol
В последние десятилетия область генной и клеточной терапии столкнулась с экспоненциальным расширением благодаря появлению нескольких клинических успехов, таких как подходы по переносу генов ex vivo, так и in vivo. Результаты этих исследований также предоставляют важную информацию о производстве клеток, разработке векторов и терапевтической эффективности, которые представляют собой прочную основу и увеличивают возможности разработки более точных подходов к редактированию генов. Несмотря на некоторое сходство между производством HSPC с переносом и редактированием генов (например, режимы кондиционирования для сбора и трансплантации HSPC, протоколы отбора, активации, культивирования и трансдукции CD34 + клеток in vitro), процедура редактирования требует дополнительных и специфических этапов манипуляции, которые только сейчас столкнутся с их первой клинической проверкой (Figure 3). Среди них процесс электропортации, используемый для доставки компонентов редактирования и трансдукция HSPC с векторами AAV6, представляет собой инновацию, связанную с основными неизвестными. Фактически, до сих пор нет прямых доказательств того, что эти процедуры действительно позволят долгосрочное приживление отредактированных HSC у человека. В то время как современные исследования ксенотрансплантации на иммунодефицитных мышах показывают многообещающие результаты, критические видо-специфические различия в процедуре редактирования генов HSPC мышей и нечеловеческих приматов (NHP) значительно влияют на урожайность, приспособленность и потенциальную иммуногенность клеточного продукта, что ограничивает прогностическую ценность таких доклинических моделей (Schiroli et al., 2017; Kim et al., 2018; Humbert et al., 2019; Wilkinson et al., 2021). Более того, масштабирование процессов лабораторного уровня до клинического уровня требует внедрения адекватных производственных мощностей, которые поддерживают масштабируемость процедур, одновременно соответствуя сложным требованиям производства current good manufacturing practices (cGMP). Идеальный процесс производства клеток должен быть надежным, воспроизводимым и рентабельным, чтобы его можно было использовать в различных терапевтических целях. Наконец, необходимо тщательно определить безопасность, чистоту и эффективность клеточных продуктов в конце технологического процесса, чтобы они соответствовали стандартам контроля качества и руководствам регулирующих органов, которые, однако, все еще нуждаются в адаптации на основе накопления дополнительных научных знаний. Действительно, производство отредактированных HSPC все еще находится в самом начале клинических испытаний, и регулирующие органы должны тесно сотрудничать с учеными, чтобы определить критические требования, которые лучше соответствовали бы потребностям этих передовых терапевтических лекарственных средств (ATMP). Некоторые клинические испытания, предполагающие нарушения генов в HSPC с помощью CRISPR-Cas9 (Frangoul et al., 2021) (NCT03745287 / NCT03655678), в настоящее время раскрывают ценную информацию для подготовки этого перехода. По мере того как будут пролиты свет на эффективные и потенциальные проблемы безопасности, станет легче определить соответствующую структуру стандартов безопасности для последующих применений.
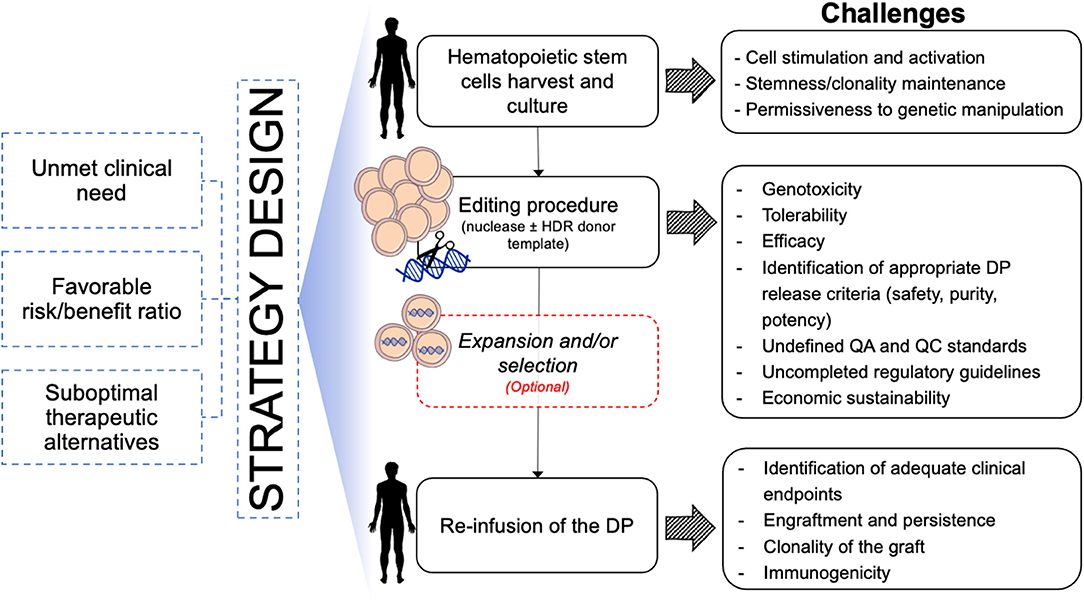
Figure 3. Бызфт class=ari8>Schematic of challenges toward clinical translation of HSPC gene editing for hematological diseases. DP, Drug Product; QA, Quality Assay; QC, Quality Control.
Tracking Edited HSPCs to Assess Safety, Efficacy, and Persistence of the Therapeutic Gene Edited Product
Дизайн клинических испытаний по редактированию генов HSPC фазы I / II не может быть забыт путем определения группы адекватных конечных точек безопасности и эффективности, которые позволят исследователям оценить, соответствует ли предлагаемое лечение терапевтическим ожиданиям с благоприятным соотношением риск / польза. Тем не менее, клинические данные должны дополняться специальными молекулярными анализами, направленными на оценку долгосрочного приживления, устойчивости и потенциала многоклональной дифференцировки отредактированных HSPC, например, путем количественной оценки эффективности редактирования в локусе-мишени с течением времени и формирования клонов гематопоэтических клеток во время наблюдения за пациентами. Более того, оценка геномной целостности, а также нуклеазной активности на проверенных нецелевых сайтах (если таковые имеются) как в произведенном клеточном продукте, так и в трансплантате пациентов, может всесторонне охарактеризовать сконструированный клеточный продукт и на ранней стадии идентифицировать клональные дрейфы, вызванные экспансией. кроветворных клонов, несущих структурные геномные аномалии или непреднамеренные результаты редактирования.
В этой структуре мониторинг клонального состава отредактированного клеточного трансплантата предоставит ценную дополнительную информацию об эффективности производственного процесса, долгосрочном потенциале многолинейного репопуляции редактируемых человеком HSPCs и профиле безопасности терапевтического подхода. Количественная оценка разнообразия indels в отредактированных аллелях генов может функционировать как суррогатное считывание клональной сложности отредактированной популяции клеток для отслеживания динамики отредактированных клонов. (McKenna et al., 2016; Kalhor et al., 2018; Roman-Rodriguez et al., 2019; Ferrari et al., 2020). Недавние исследования на моделях NHP показали заметное снижение клональной сложности от введенного клеточного продукта до трансплантата с прямой корреляцией между количеством мультиклональных репопулирующих клонов и введенной дозой отредактированных клеток. (Demirci et al., 2020). Тем не менее, предпочтительное создание специфических редактирований генов посредством NHEJ репарирования (van Overbeek et al., 2016) и возникновение дву-аллельных модификаций может не обеспечить достаточной сложности редактируемой генами популяции аллелей для исчерпывающего исследования клонального состава. Использование уникального молекулярного идентификатора (например, случайных последовательностей ДНК, используемых в качестве суррогатных штрих-кодов), встроенного в HDR матрицу, позволило бы отслеживать отредактированные HDR клоны, которые в противном случае были бы неотличимы друг от друга из-за высокой точности HDR. Редактирование HSPC с помощью матрицы со штрих-кодом выявило олигоклональный состав ксенотрансплантата человека, отредактированного с помощью HDR, у мышей с иммунодефицитом (Ferrari et al., 2020; Sharma et al., 2021), в основном связанный с биологическим воздействием процедуры редактирования, хотя большая часть приживляющихся клонов по-прежнему сохраняла мультиклональность и потенциал самообновления . Хотя создание и использование библиотек HDR-матриц со штрих-кодами подходящей сложности для клинического применения будет чрезвычайно сложной задачей и может вызвать теоретически проблемы безопасности из-за случайной генерации и интеграции потенциально функциональных / регуляторных последовательностей ДНК (например, сайтов связывания факторов транскрипции), этот инструмент может быть полезен для проверки производственного процесса и использования улучшенных протоколов редактирования.
В целом, доклинические наблюдения за динамикой клонов подтверждают долгосрочную устойчивость отредактированных HSPC после трансплантации, даже несмотря на то, что вышеупомянутая потеря клональной сложности от введенного продукта к отредактированному клеточному трансплантату побуждает к внедрению и оптимизации производственных процессов с низкой нагрузкой, а также мониторинг клонального состава трансплантата в клинических испытаниях по редактированию генов HSPC, проводимых впервые на людях.
Economic Sustainability of ATMPs Based on Edited HSPCs
Редактирование генов HSPC - это форма персонализированной медицины, которая в настоящее время влечет за собой сложные и дорогостоящие процедуры, особенно в отношении процессов производства и доставки, которые поднимают цены на такие ATMP до миллионов долларов США. Как это произошло с терапией по замещению генов, некоторые из которых уже достигли одобрения Food and Drug Administration (FDA) и European Medicines Agency (EMA) для коммерческого использования (Touchot and Flume, 2017), такие высокие затраты могут быть приемлемыми для разработки более эффективных методов лечения ультра-редких и редких заболеваний, особенно в некоторых странах. Действительно, (i) однократное введение терапии может обеспечить стабильные преимущества при значительной экономии затрат на повторное пожизненное применение традиционных методов лечения и (ii) ограниченное количество пролеченных пациентов не окажет существенного влияния на систему возмещения, за исключением вероятной необходимости разделить оплату одноразового лечения и распределить кредит на несколько лет, таким образом имитируя бремя пожизненной терапии. Тем не менее, теперь, когда планка этих передовых терапевтических подходов была поднята, чтобы охватить более частые заболевания, затрагивающие большое количество людей, такие как гемоглобинопатии, эта бизнес-модель может оказаться неадекватной. Риск заключается в том, что такие высокие затраты на производство ATMP могут наложить социально-экономические ограничения, которые могут затруднить доступ к этим новым методам лечения и / или ограничить их устойчивую коммерциализацию, что в конечном итоге повлияет на их доступность для пациентов (Wilson and Carroll, 2019). Тем не менее, быстро развивающиеся технологические достижения в области генной терапии в целом считаются безграничным источником решений вышеупомянутых проблем. Разработка более эффективных систем производства векторов, таких как передовые способы упаковки или улучшенные стратегии очистки (Grieger et al., 2016; Kotin and Snyder, 2017), а также внедрение небольших автоматизированных закрытых систем для производства клеток, которые позволяют децентрализованное поколение клеточных терапий "по месту оказания помощи" еще больше упростит клинические испытания генно-редактируемых ATMP и вскоре значительно снизит их производственные затраты. Действительно, потенциал для экономически устойчивого маркетинга генных терапий ex vivo хорошо подкрепляется растущим интересом крупных фармацевтических и венчурных капиталов к этой области, которые предвидят благоприятный финансовый баланс для этих передовых методов лечения в ближайшем будущем.
Gene Addition vs. Gene Editing: Overlapping or Divergent Potential?
Перенос генов с помощью RV стал важной вехой в истории генной терапии. К сожалению, ранний энтузиазм, связанный с терапевтическим потенциалом врожденных иммунодефицитов, был внезапно подавлен частой злокачественной трансформацией трансдуцированных клеток (Cavazzana-Calvo et al., 2000; Hacein-Bey-Abina et al., 2003a, b, 2008; Howe et al. ., 2008; Stein et al., 2010; Braun et al., 2014) из-за избыточной экспрессии прото-онкогенов, запускаемой энхансерными последовательностями в области U3 5' с длинного концевого повтора (LTR) соседнего интегрированного вектора. Переход от RV к платформе LV и создание самоинактивирующихся векторов путем делеции последовательностей энхансера LTR привели к более безопасному профилю интеграции (Montini et al., 2006) и повлекли за собой широкое использование современных LV для ряда заболеваний, таких как гемоглобинопатии, энзимопатии и врожденные иммунодефициты (Sessa et al., 2016; Fraldi et al., 2018; Thompson et al., 2018; Mamcarz et al., 2019; Marktel et al., 2019; Kohn et al., 2020).
Поскольку вариабельность числа копий межклеточного вектора, полу-случайный паттерн интеграции и грубая регуляция экспрессии кассеты не являются проблемой априори, LV, возможно, являются лучшей доступной платформой для добавления генов. Однако некоторые события генотоксичности могут все еще происходить при интеграции LV, например, опосредованное вектором нарушение соответствующих геномных элементов или генов-супрессоров опухолей и / или генерация аберрантных вариантов сплайсинга эндогенных генов, слитых с кассетой трансгена. (Cavazzana-Calvo et al., 2010). Кроме того, восстановление сложной физиологической регуляции трансгена в предельном размере векторной кассеты может представлять дополнительную проблему в контексте некоторых заболеваний. Полу-случайный паттерн интеграции RV и LV препятствует их использованию при тех заболеваниях, где нерегулируемая экспрессия корректирующего гена может иметь потенциально опасные последствия, например, в случае генов, которые оказывают прямое влияние на пролиферацию и / или дифференцировку клеток или гены, которым необходим высокий уровень экспрессии для восстановления их физиологической функции. Эти категории заболеваний включают несколько первичных иммунодефицитов, таких как синдром Hyper IgM 1 (Brown et al., 1998; Sacco et al., 2000; Hubbard et al., 2016; Kuo et al., 2018; Vavassori et al., 2021). , Дефицит RAG1 / RAG2 (Villa et al., 2020) и, возможно, анемия Фанкони (Roman-Rodriguez et al., 2019; van de Vrugt et al., 2019), для которых предполагается повышенный риск трансформации клеток или неадекватной экспрессии в настоящее время ограничивают развитие конкурентных подходов к добавлению генов и, таким образом, могут представлять собой подходящие условия для первых испытаний на людях подходов к сайт-специфическому редактированию генов. Более того, терапевтическое редактирование генома также расширяет возможные применения точной ДНК-хирургии до нескольких вакантных клинических контекстов, которые не могут быть эффективно решены с помощью традиционных стратегий генной терапии. Среди прочего, создание ВИЧ-устойчивых нокаут-клеток CCR5 (Xu et al., 2017, 2019), делеция регуляторных областей (Bauer et al., 2013) или коррекция доминантно-негативных мутаций (Nasri et al. , 2020) - это приложения, требующие исключительно сайт-специфичного действия программируемых ферментов.
Помимо вышеупомянутых примеров, потенциальные способы добавления генов и редактирования генов в значительной степени перекрываются. В самом деле, некоторая степень конкуренции может возникать в отношении конкретных заболеваний, в результате чего восстановление функции генов на месте, как ожидается, принесет пользу с точки зрения экспрессии. Например, генная терапия на основе LV для лечения WAS уменьшала количество кровотечений, но не полностью восстанавливала уровень тромбоцитов (Ferrua et al., 2019). Хотя виновник не совсем ясен (Fischer, 2019), было высказано предположение, что полное восстановление физиологической экспрессии in situ требуется для полной коррекции фенотипа, что открывает двери для стратегий редактирования генов. (Rai et al., 2020). Другой примерный случай - гемоглобинопатии, при которых клиническая польза теоретически может быть достигнута (i) добавлением / коррекцией гена HBB или (ii) восстановлением экспрессии Hb-F путем инактивации BCL11A (Sankaran et al., 2008; Basak et al. , 2015). С одной стороны, добавление гена HBB оказалось возможным как при ВСС, так и при β-талассемии (Thompson et al., 2018; Marktel et al., 2019), очевидно, оставляя меньше места для редактирования HBB на основе HDR. (Dever et al., 2016; DeWitt et al., 2016; Kuo et al., 2018; Park et al., 2019; Pattabhi et al., 2019). С другой стороны, подавление BCL11A было успешно достигнуто как с помощью LV, кодирующего BCL11A-специфическую короткую шпилечную РНК (Esrick et al., 2021), так и с помощью CRISPR-опосредованного нокаута (Frangoul et al., 2021). В любом случае ожидается, что безопасность, эффективность и рыночный успех этих новых методов лечения, независимо от платформы, будут сравнима с betibeglogene autotemcel (Zynteglo), который недавно был одобрен FDA для лечения β-талассемии (в то время как одобрение для SCD все еще на рассмотрении) . Поскольку гемоглобинопатии относительно часты, вполне возможно, что методы лечения с добавлением генов и редактирования генов по одним и тем же показаниям получат одобрение на рынке как в США, так и в других странах. Это позволит в не столь отдаленном будущем провести параллельное сравнение различных технологий в реальной жизни, которое выявит их соответствующие преимущества и недостатки, несмотря на то, что, вероятно, останется место для более чем одного победителя, как это обычно происходит с другими. более традиционные методы лечения (Fernandes et al., 2020).
В целом, текущая эффективность HDR-опосредованной коррекции генов значительно ниже, чем эффективность, достигаемая с помощью LV, что снижает ее конкурентное преимущество для ряда приложений, в которых требуется высокая доля исправленных клеток. Тем не менее, дамоклов меч генотоксичности висит как на LV, так и на платформах редактирования генов, либо из-за интеграции и инактивации генов-супрессоров рака, либо из-за геномных перестроек и эффектов вне мишени.
Conclusions
The outstanding advantages and the current technological limitations of targeted genome editing are the main weights in the two sides of the scale when considering the opportunity of translating intriguing new therapeutic approaches into clinics. However, their “weight” might remarkably change depending on the target disease. Therefore, the decision to move gene editing toward human testing requires a case-by-case assessment and must be balanced against clinical need. In this scenario, the presence of competing treatments, either as standard of care or under clinical evaluation, and the costs of developing and commercializing ATMPs, might further restrict the space for the application of HSPC gene editing in blood disorders (Wilson and Carroll, 2019).
Ultimately, the rationale of testing novel gene editing-based strategies depends on the presumed benefit offered to the patient with respect to his prognosis with the best available therapy. It is reasonable to offer HSPC gene editing based products at first to patients with no alternative options and a dismal prognosis or to those for who the standard of care is presumed to be more toxic, such as those affected by severe congenital immunodeficiencies or DNA repair defects. Clinical testing of gene editing approaches in these applications would provide a first detailed characterization of their safety profile. This would also allow to define the appropriate assays to follow the dynamics of unwanted genomic events in time and establish their clinical relevance, setting the thresholds to manage the genotoxic risk. These data would then pave the way for their application to other diseases with a less dismal prognosis and alternative therapies, such as HIV and enzymopathies.
Gene Editing for Hematological Diseases
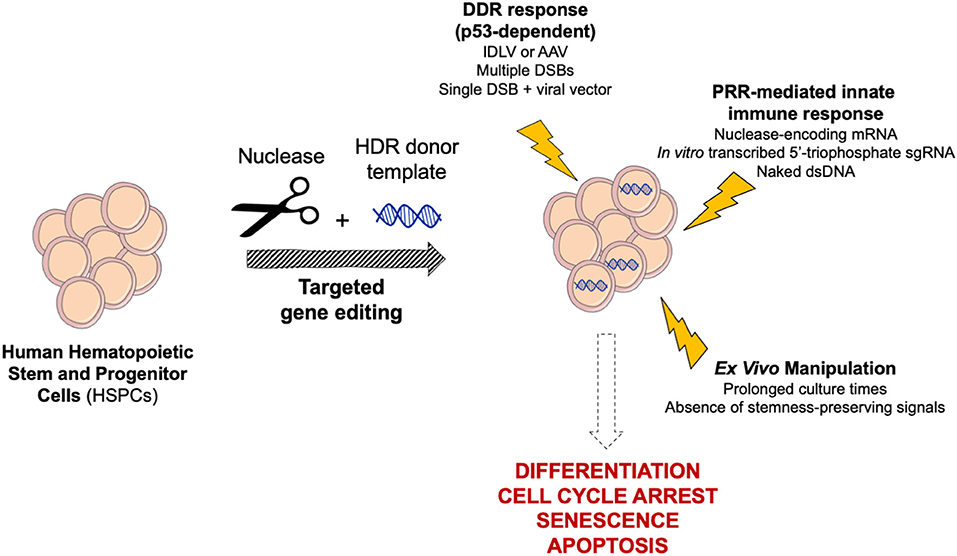 FIGURE 2 |Бызфт class=ari8> Schematic of cellular responses triggered by targeted genome editing in human HSPCs. Gene editing reagents, procedure and ex vivo manipulation may trigger complex cellular responses in HSPCs, ultimately leading to differentiation, cell cycle arrest, senescence, and apoptosis. DDR, DNA Damage Response; PRR, Pattern Recognition Receptor.
|
 FIGURE 1 | Schematic of the main DNA double strand break repair mechanisms in human cells and their possible applications for targeted genome editing. NHEJ pathway engagement may be exploited for knocking-out a gene, correcting a gene by restoring its open reading frame (ORF), inserting a targeted deletion. HDR pathway engagement may be exploited for gene correction of point or multiple mutations, gene addition in a safe harbor locus or targeted transgene expression using endogenous regulatory elements. Mut. GOI, Mutated Gene Of Interest. culture of HSPCs for 48 or 72 h before editing, in presence of cytokine mixtures containing at least SCF, FLT-3L, and TPO (Walasek et al., 2012), pushes repopulating cells to exit from quiescence and transit through S/G2 phases, thus increasing HDR efficiency (Genovese et al., 2014; Zonari et al., 2017; Bak et al., 2018). However, prolonged culture times lead to cell differentiation and multipotency loss.
FIGURE 1 | Schematic of the main DNA double strand break repair mechanisms in human cells and their possible applications for targeted genome editing. NHEJ pathway engagement may be exploited for knocking-out a gene, correcting a gene by restoring its open reading frame (ORF), inserting a targeted deletion. HDR pathway engagement may be exploited for gene correction of point or multiple mutations, gene addition in a safe harbor locus or targeted transgene expression using endogenous regulatory elements. Mut. GOI, Mutated Gene Of Interest. culture of HSPCs for 48 or 72 h before editing, in presence of cytokine mixtures containing at least SCF, FLT-3L, and TPO (Walasek et al., 2012), pushes repopulating cells to exit from quiescence and transit through S/G2 phases, thus increasing HDR efficiency (Genovese et al., 2014; Zonari et al., 2017; Bak et al., 2018). However, prolonged culture times lead to cell differentiation and multipotency loss. Figure 3. Бызфт class=ari8>Schematic of challenges toward clinical translation of HSPC gene editing for hematological diseases. DP, Drug Product; QA, Quality Assay; QC, Quality Control.
Figure 3. Бызфт class=ari8>Schematic of challenges toward clinical translation of HSPC gene editing for hematological diseases. DP, Drug Product; QA, Quality Assay; QC, Quality Control.
 FIGURE 2 |Бызфт class=ari8> Schematic of cellular responses triggered by targeted genome editing in human HSPCs. Gene editing reagents, procedure and ex vivo manipulation may trigger complex cellular responses in HSPCs, ultimately leading to differentiation, cell cycle arrest, senescence, and apoptosis. DDR, DNA Damage Response; PRR, Pattern Recognition Receptor.
FIGURE 2 |Бызфт class=ari8> Schematic of cellular responses triggered by targeted genome editing in human HSPCs. Gene editing reagents, procedure and ex vivo manipulation may trigger complex cellular responses in HSPCs, ultimately leading to differentiation, cell cycle arrest, senescence, and apoptosis. DDR, DNA Damage Response; PRR, Pattern Recognition Receptor.