Посещений: 
ТЕРАПИЯ, БАЗИРУЮЩАЯСЯ НА микроРНК
Успехи
RNA-Based Therapeutics: From Antisense Oligonucleotides to miRNAs Sarah Bajan and Gyorgy Hutvagner Cells 2020, 9(1), 137; https://doi.org/10.3390/cells9010137
| |
|
1.1. Therapeutic Nucleic Acids
Большинство болезней человека зависят от генетических факторов [1]. Поэтому одним из способов лечения является генотерапия, замена гена, связанного с болезнью, на 'здоровую' версию гена или генного продукта. Первой разрешенной генотерапией людей стало в 1990 лечение дефицита adenosine deaminase [2]. Преимуществом генотерапии является то, что она может успешно излечивать генетические болезни, как это было продемонстрировано в 2002, на пациентах с severe combined immunodeficiency (SCID) [3]. Сегодня генотерапия использу6ется и при более сложных нарушениях, подобных нейродегенеративной болезни Альцгеймера [4] и полигенных раках [5].
Базирующееся на ДНК лечение, однако, не ограничено замещением гена [6]. ДНК также широко используется для генетической иммунизации. ДНК вакцины сегодня ограничены ветеринарными клиниками. Однако, клинические испытания проводятся на людях с целью защиты от малярии, HIV, гриппа, туберкулёза и Ebola [7].
Первое лекарство в виде нуклеиновой кислоты, которое было разрешено United States Food and Drug Administration (FDA), это fomivirsen (Vitravene), разработанное для страдающих от иммунных нарушений пациентов с cytomegalovirus (CMV) ретинитом [8]. Fomivirsen является антисмысловым ДНК олигонуклеотидом, который комплементарен региону транскрипта CMV, он предотвращает репликацию вируса [9]. Некоторые базирующиеся на ДНК лекарства были разрешены с тех пор и это всё ещё активная область исследований. Однако, многие biopharmaceutical компании концентрируются на др. нуклеиновых кислотах, обладающих терапевтическим потенциалом, на РНК.
1.2. The Emergence of RNA-Based Drugs
Благодаря разработке технологии секвенирования и высоко-производительным статистическим и экспериментальным подходам, становится возможной аккуратная идентификация, специфических вызывающих болезнь генетических вариантов и генов [10]. Это становится существенной проблемой в области геномики, особенно когда определяются причинные механизмы полигенных болезней, их рисковые варианты и разнообразие типов клеток и окружения [10].
Традиционные лекарства в виде малых молекул борются с патологией путем модулирования нижестоящих путей гена, вызывающего болезнь. Однако, более аккуратная и эффективная лечебная стратегия, которая сегодня появляется в клинике, заключается в модификации виновного генного продукта путем целенаправленного воздействия на ДНК или РНК предшественники, используемые для генотерапии.
Сегодня многие фармацевтические и биотехнологические компании разрабатывают базирующуюся на РНК терапию, чтобы специфически регулировать гены, вызывающие болезнь и их варианты. Горстка базирующихся на РНК продуктов была успешно разрешена для использования в клинике, со многими другими находящимися на разных стадиях разработки лекарств. Большинство этих продуктов являются синтетическими, некодирующими, non-coding RNAs (ncRNAs) [11,12].
Эндогенные ncRNAs кодируются в геноме и выполняют важные функции в регуляции генной экспрессии, и благодаря повышению аккуратности и чувствительности технологий, мы быстро расширяем наши знания о специфичности их экспрессии. Многие ncRNAs по разному экспрессируются в болезненном состоянии и , как полагают, вносят вклад в возникновение и развитие болезни. Поэтому они обладают огромным потенциалом в качестве диагностических меток, терапевтических мишеней или лекарств [13].
Открытие в 1993 [14,15] базирующихся на microRNA (miRNA) лекарств всё ещё не достигло клиники. miRNAs, класс ncRNA, это небольшие (~21 нуклеотид), однонитчатые молекулы РНК, которые преимущественно регулируют пост-транскрипционные стадии экспрессии генов. miRNA загружаетс на белок Argonaute (Ago), чтобы сформировать RNA Induced Silencing Complex (RISC) [16]. RISC является минимальным эффекторным комплексом для обеспечиваемых с помощью miRNA механизмов регуляции генов. Осуществляемое с помощью miRNAs комплементарное связывание с сайтом транскрипта мишени, обычно обнаруживается в 3' нетранслируемом регионе (UTR), RISC репрессирует трансляцию мРНК посредством одного из нескольких возможных механизмов (Figure 1) [17]. Идентифицировано около 2000 miRNAs у человека [18], каждая из которых имеет самостоятельный паттерн экспрессии и специфический набор мишеней miRNAs. Следовательно, почти каждый биологический процесс контролируется с помощью miRNA-обеспечиваемых механизмов регуляции [17,19].
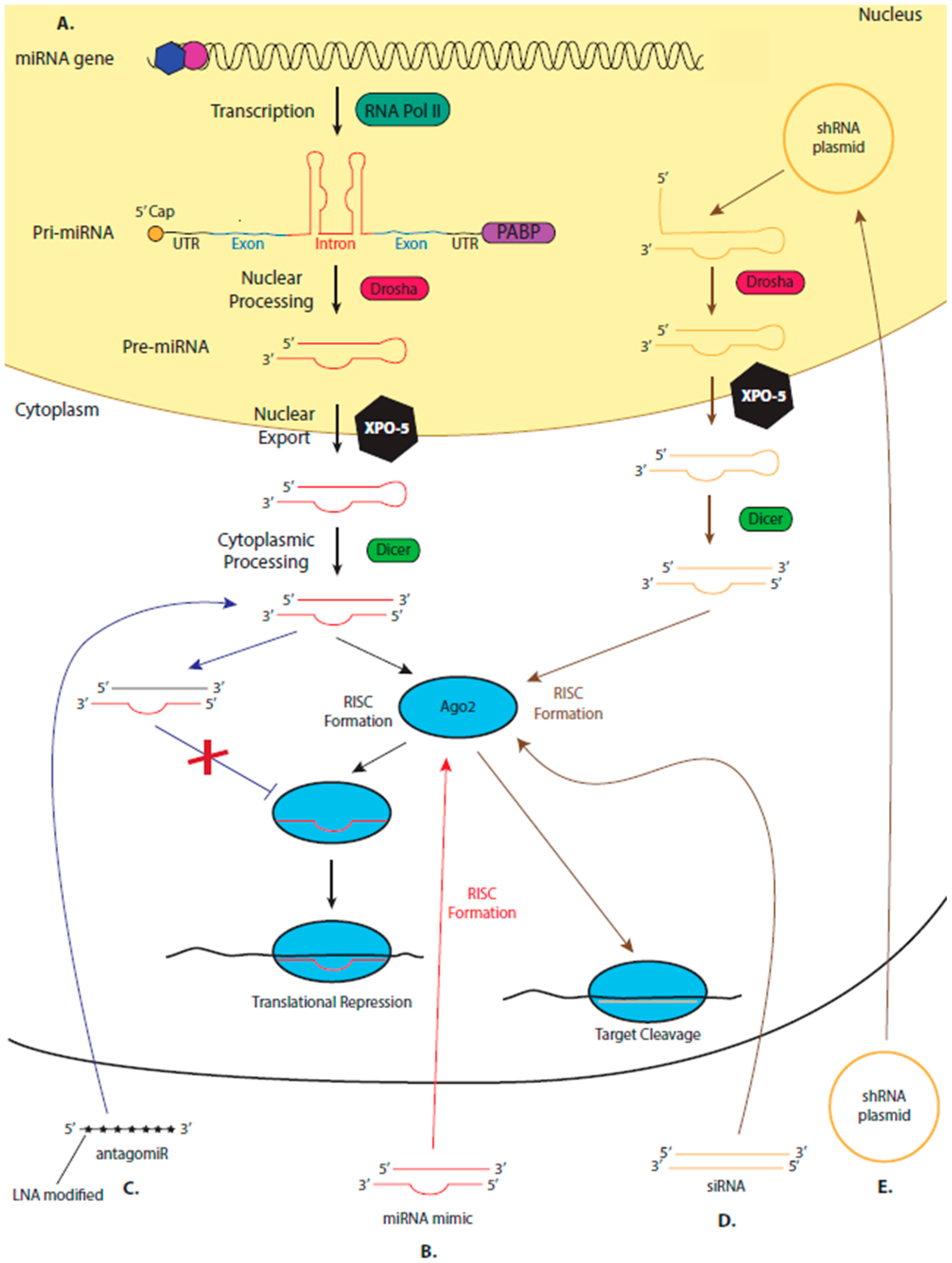
Figure 1. Mechanisms of RNA-based therapeutics that are dependent on the endogenous microRNA (miRNA) pathway. (A) miRNAs are encoded in the genome, often in the intron of protein-coding genes. The transcript, produced by RNA polymerase II, containing the miRNA forms a characteristic stem-loop structure which is processed in the nucleus by an RNases III enzyme, Drosha, to form an RNA hairpin (approx. 70 nucleotides) called the pre-miRNA. Pre-miRNA moves into the cytoplasm via exportin-5 (XPO-5), where it is further processed by Dicer, producing a double-stranded miRNA-miRNA* duplex. One strand of this duplex is loaded onto an Argonaute (Ago protein) to from the RNA-induced silencing complex (RISC). The other strand of the duplex (the passenger strand) is degraded. RISC is guided by the loaded miRNA strand which imperfectly binds to complementary sites commonly found in the 3' untranslated region (UTR) of target mRNAs. RISC inhibits the translation of the bound mRNA and can cause deadenylation and degradation of the targeted transcript. Therapeutic miRNA mimics (B) are synthesized as miRNA duplexes. Upon entry into the cell, one strand binds to an endogenous Ago protein forming RISC, while the passenger strand degrades. The synthesized miRNA acts as a guide, directing the RISC to the therapeutic target, and inhibiting its translation. (C) AntagomiRs are single-stranded, synthesized, modified RNA molecules which are complementary to an endogenous miRNA. Upon entry into the cell, the antagomiR will bind to its target miRNA, preventing the miRNA from being loaded onto an Ago protein and forming RISC. (D) Once therapeutic siRNA duplexes enter the cell, one strand is loaded onto an Ago2 protein forming RISC. RISC is directed to the target mRNA by the loaded siRNA which binds with 100% complementarity to its target, Ago2 then cleaves the transcript. (E) DNA plasmids designed to encode short hairpin (sh) RNA enter the cell nucleus, where they are transcribed, producing an RNA with a characteristic stem-loop structure, allowing the RNA to enter the endogenous miRNA biogenesis pathway.
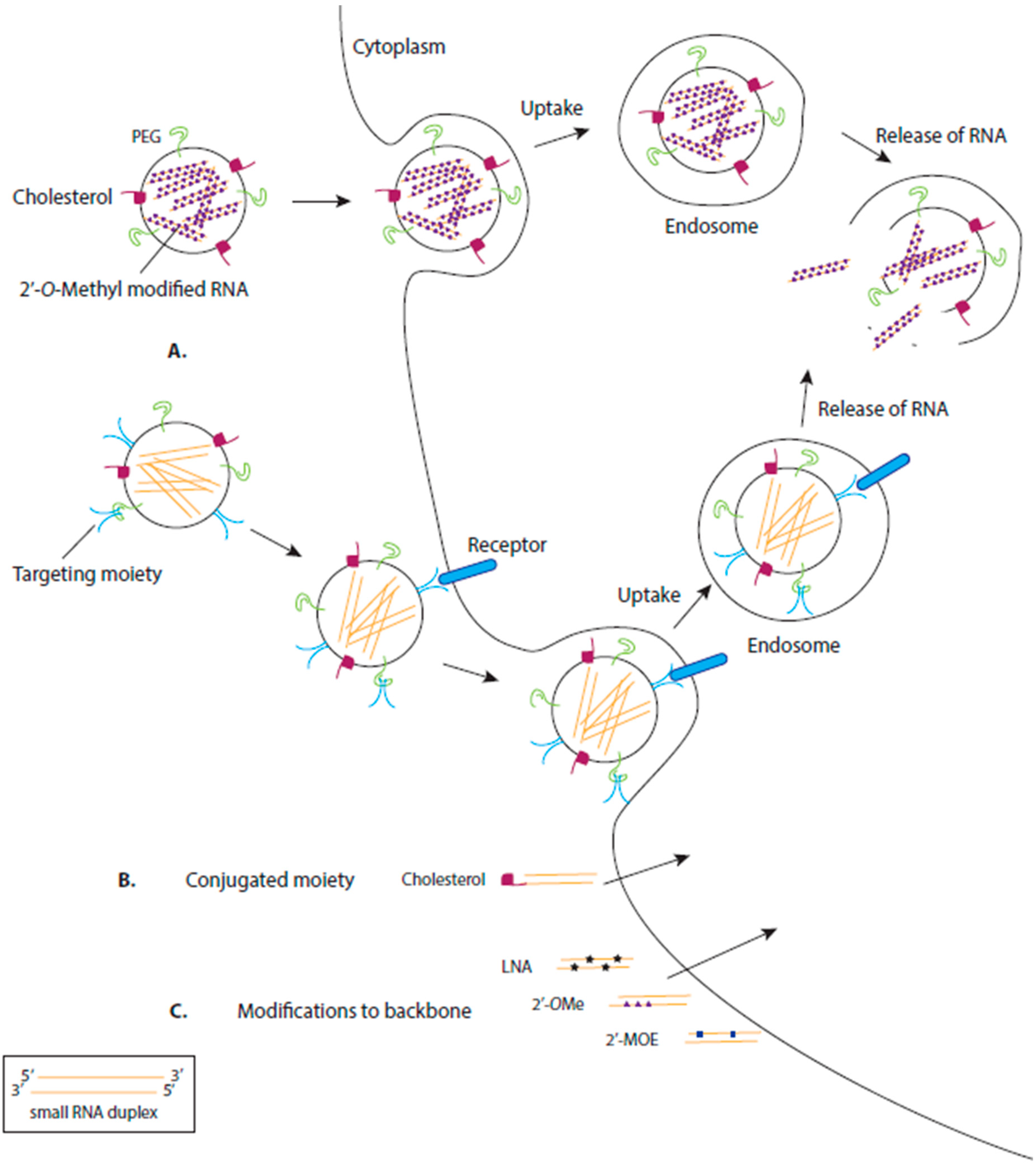 Figure 2
Common Delivery Methods for RNA-based Therapeutics. (A) RNA-based therapeutics are often encapsulated, or attached on the surface of, nanoparticles to aid delivery of the drug into the cell. These nanoparticles are often modified with moieties such as cholesterol or polyethylene glycol (PEG) which aid uptake of the nanoparticle via the cell membrane. Some nanoparticles are directed to particular cells by the addition of a targeting moiety, often a ligand for a cell surface receptor specifically expressed on the target cell. Commonly, the nanoparticle enters the cell via endocytosis, forming an endosome, which, after environmental changes (e.g., lowered pH), degrades, releasing the RNA therapeutic into the cell. (B) Alternatively, some RNA therapeutics are directly conjugated to moieties to aid their transport across the cell membrane, e.g., cholesterol (C) Synthesized RNA therapeutics can be chemically modified to increase their stability and binding affinity and decrease their toxicity. LNA: locked nucleic acid (2?4?-methylene; 2?OMe: 2?-O-methyl; 2?MOE: 2?-O-methoxyethyl. Figure 2
Common Delivery Methods for RNA-based Therapeutics. (A) RNA-based therapeutics are often encapsulated, or attached on the surface of, nanoparticles to aid delivery of the drug into the cell. These nanoparticles are often modified with moieties such as cholesterol or polyethylene glycol (PEG) which aid uptake of the nanoparticle via the cell membrane. Some nanoparticles are directed to particular cells by the addition of a targeting moiety, often a ligand for a cell surface receptor specifically expressed on the target cell. Commonly, the nanoparticle enters the cell via endocytosis, forming an endosome, which, after environmental changes (e.g., lowered pH), degrades, releasing the RNA therapeutic into the cell. (B) Alternatively, some RNA therapeutics are directly conjugated to moieties to aid their transport across the cell membrane, e.g., cholesterol (C) Synthesized RNA therapeutics can be chemically modified to increase their stability and binding affinity and decrease their toxicity. LNA: locked nucleic acid (2?4?-methylene; 2?OMe: 2?-O-methyl; 2?MOE: 2?-O-methoxyethyl.
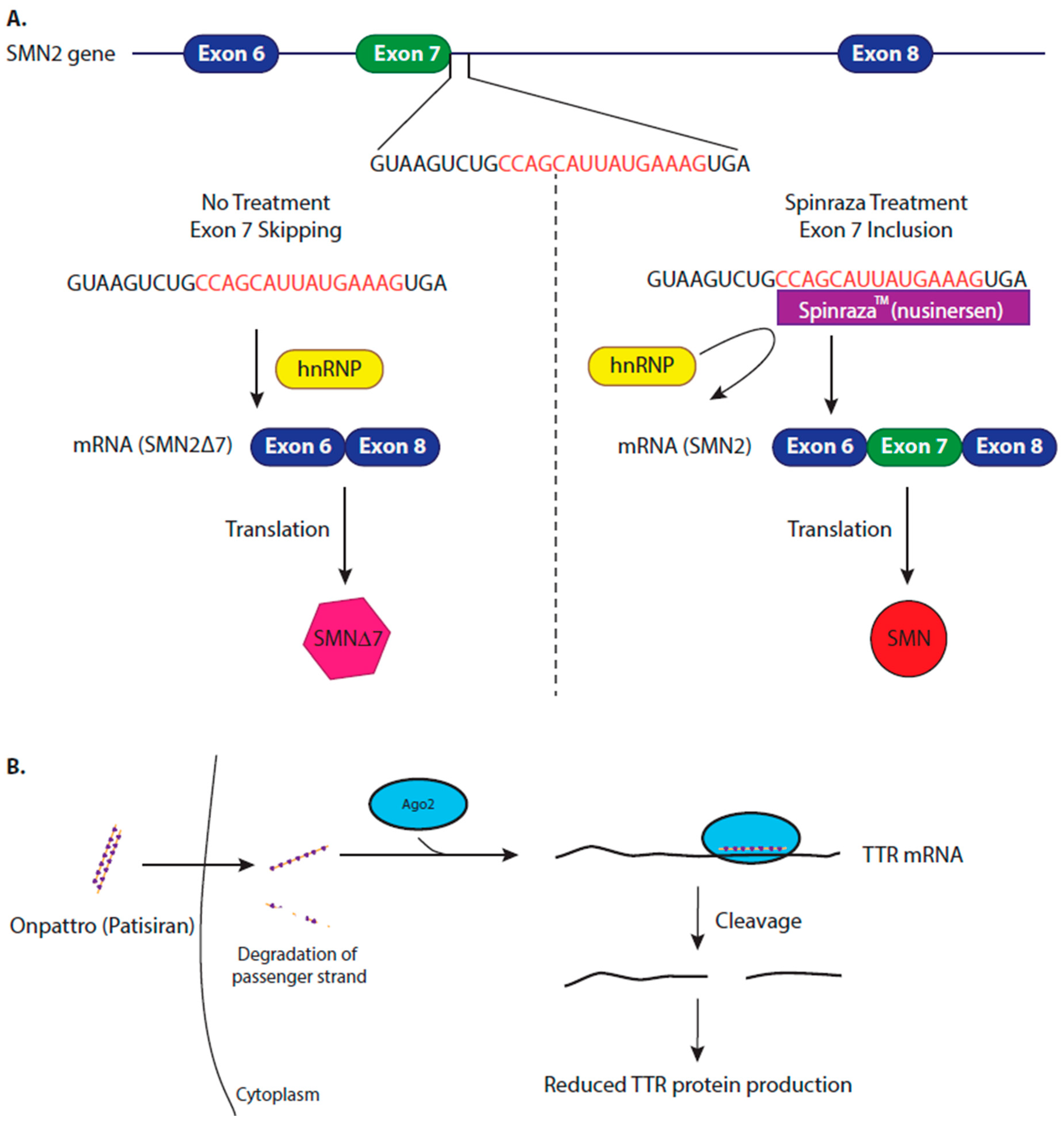 Figure 3
Mechanism of approved therapeutics. (A) Nusinersen regulates splicing of the Survival Motor Neuron (SMN) 2 gene to treat patients with spinal muscular atrophy (SMA). Due to weak splice site, masked by the binding of hnRNP, the SMN2 gene usually produces a truncated transcript lacking exon 7, which, when translated, produces a non-functional and unstable protein (SMN2?7). Nusinersen (SpinrazaTM, Biogen) is an antisense oligonucleotide (ASO) therapy that binds, via complementarity, to SMN2 pre-mRNA, displacing hnRNP, exposing the splice site and increasing the inclusion of exon 7, forming a full-length, mature SMN2 transcript. Once translated, this produces a full-length, functional SMN protein, which improves patient’s motor neuron function and slows disease progression. (B) Patisiran (Onpattro) reduces the production of transthyrethin (TTR) protein to reduce the formation of amyloid fibrils in hereditary transthyretin-mediated (hATTR) amyloidosis. Mutations in the TTR gene causes misfolding of the TTR protein, the misfolded protein aggregates into amyloid fibrils. Patisiran is a synthesized siRNA therapy, which is 100% complementary to a specific sequence in the 3? UTR of the TTR mRNA. Once Patisiran enters the cell, one strand of the short interfering RNA (siRNA) duplex is loaded onto an Ago2 protein, forming RISC. RISC binds to the TTR transcript, which is subsequently cleaved by Ago2, therefore reducing TTR protein production, preventing further amyloidosis and improving patient’s quality of life. Figure 3
Mechanism of approved therapeutics. (A) Nusinersen regulates splicing of the Survival Motor Neuron (SMN) 2 gene to treat patients with spinal muscular atrophy (SMA). Due to weak splice site, masked by the binding of hnRNP, the SMN2 gene usually produces a truncated transcript lacking exon 7, which, when translated, produces a non-functional and unstable protein (SMN2?7). Nusinersen (SpinrazaTM, Biogen) is an antisense oligonucleotide (ASO) therapy that binds, via complementarity, to SMN2 pre-mRNA, displacing hnRNP, exposing the splice site and increasing the inclusion of exon 7, forming a full-length, mature SMN2 transcript. Once translated, this produces a full-length, functional SMN protein, which improves patient’s motor neuron function and slows disease progression. (B) Patisiran (Onpattro) reduces the production of transthyrethin (TTR) protein to reduce the formation of amyloid fibrils in hereditary transthyretin-mediated (hATTR) amyloidosis. Mutations in the TTR gene causes misfolding of the TTR protein, the misfolded protein aggregates into amyloid fibrils. Patisiran is a synthesized siRNA therapy, which is 100% complementary to a specific sequence in the 3? UTR of the TTR mRNA. Once Patisiran enters the cell, one strand of the short interfering RNA (siRNA) duplex is loaded onto an Ago2 protein, forming RISC. RISC binds to the TTR transcript, which is subsequently cleaved by Ago2, therefore reducing TTR protein production, preventing further amyloidosis and improving patient’s quality of life.
Благодаря их пространному влиянию на регуляцию генов, функция и экспрессия miRNA контролируется в пространстве и во время онтогенеза, это существенно для предопределения и поддержания клеточной дифференцировки и качественных характеристик. Следовательно, не удивительно, что экспрессия miRNA изменяется пи многих болезнях и, как было установлено, выполняет многочисленные роли в возникновении и прогрессировании некоторых болезней [20-4] и активно исследуется и разрабатывается для клинического использования [25].
В обзоре обсуждается пригодность и ограничения базирующихся на РНК лекарств и почему лечение с помощью miRNA имеет столь ограниченный успех.
|
 Figure 1. Mechanisms of RNA-based therapeutics that are dependent on the endogenous microRNA (miRNA) pathway. (A) miRNAs are encoded in the genome, often in the intron of protein-coding genes. The transcript, produced by RNA polymerase II, containing the miRNA forms a characteristic stem-loop structure which is processed in the nucleus by an RNases III enzyme, Drosha, to form an RNA hairpin (approx. 70 nucleotides) called the pre-miRNA. Pre-miRNA moves into the cytoplasm via exportin-5 (XPO-5), where it is further processed by Dicer, producing a double-stranded miRNA-miRNA* duplex. One strand of this duplex is loaded onto an Argonaute (Ago protein) to from the RNA-induced silencing complex (RISC). The other strand of the duplex (the passenger strand) is degraded. RISC is guided by the loaded miRNA strand which imperfectly binds to complementary sites commonly found in the 3' untranslated region (UTR) of target mRNAs. RISC inhibits the translation of the bound mRNA and can cause deadenylation and degradation of the targeted transcript. Therapeutic miRNA mimics (B) are synthesized as miRNA duplexes. Upon entry into the cell, one strand binds to an endogenous Ago protein forming RISC, while the passenger strand degrades. The synthesized miRNA acts as a guide, directing the RISC to the therapeutic target, and inhibiting its translation. (C) AntagomiRs are single-stranded, synthesized, modified RNA molecules which are complementary to an endogenous miRNA. Upon entry into the cell, the antagomiR will bind to its target miRNA, preventing the miRNA from being loaded onto an Ago protein and forming RISC. (D) Once therapeutic siRNA duplexes enter the cell, one strand is loaded onto an Ago2 protein forming RISC. RISC is directed to the target mRNA by the loaded siRNA which binds with 100% complementarity to its target, Ago2 then cleaves the transcript. (E) DNA plasmids designed to encode short hairpin (sh) RNA enter the cell nucleus, where they are transcribed, producing an RNA with a characteristic stem-loop structure, allowing the RNA to enter the endogenous miRNA biogenesis pathway.
Figure 1. Mechanisms of RNA-based therapeutics that are dependent on the endogenous microRNA (miRNA) pathway. (A) miRNAs are encoded in the genome, often in the intron of protein-coding genes. The transcript, produced by RNA polymerase II, containing the miRNA forms a characteristic stem-loop structure which is processed in the nucleus by an RNases III enzyme, Drosha, to form an RNA hairpin (approx. 70 nucleotides) called the pre-miRNA. Pre-miRNA moves into the cytoplasm via exportin-5 (XPO-5), where it is further processed by Dicer, producing a double-stranded miRNA-miRNA* duplex. One strand of this duplex is loaded onto an Argonaute (Ago protein) to from the RNA-induced silencing complex (RISC). The other strand of the duplex (the passenger strand) is degraded. RISC is guided by the loaded miRNA strand which imperfectly binds to complementary sites commonly found in the 3' untranslated region (UTR) of target mRNAs. RISC inhibits the translation of the bound mRNA and can cause deadenylation and degradation of the targeted transcript. Therapeutic miRNA mimics (B) are synthesized as miRNA duplexes. Upon entry into the cell, one strand binds to an endogenous Ago protein forming RISC, while the passenger strand degrades. The synthesized miRNA acts as a guide, directing the RISC to the therapeutic target, and inhibiting its translation. (C) AntagomiRs are single-stranded, synthesized, modified RNA molecules which are complementary to an endogenous miRNA. Upon entry into the cell, the antagomiR will bind to its target miRNA, preventing the miRNA from being loaded onto an Ago protein and forming RISC. (D) Once therapeutic siRNA duplexes enter the cell, one strand is loaded onto an Ago2 protein forming RISC. RISC is directed to the target mRNA by the loaded siRNA which binds with 100% complementarity to its target, Ago2 then cleaves the transcript. (E) DNA plasmids designed to encode short hairpin (sh) RNA enter the cell nucleus, where they are transcribed, producing an RNA with a characteristic stem-loop structure, allowing the RNA to enter the endogenous miRNA biogenesis pathway.  Figure 2
Common Delivery Methods for RNA-based Therapeutics. (A) RNA-based therapeutics are often encapsulated, or attached on the surface of, nanoparticles to aid delivery of the drug into the cell. These nanoparticles are often modified with moieties such as cholesterol or polyethylene glycol (PEG) which aid uptake of the nanoparticle via the cell membrane. Some nanoparticles are directed to particular cells by the addition of a targeting moiety, often a ligand for a cell surface receptor specifically expressed on the target cell. Commonly, the nanoparticle enters the cell via endocytosis, forming an endosome, which, after environmental changes (e.g., lowered pH), degrades, releasing the RNA therapeutic into the cell. (B) Alternatively, some RNA therapeutics are directly conjugated to moieties to aid their transport across the cell membrane, e.g., cholesterol (C) Synthesized RNA therapeutics can be chemically modified to increase their stability and binding affinity and decrease their toxicity. LNA: locked nucleic acid (2?4?-methylene; 2?OMe: 2?-O-methyl; 2?MOE: 2?-O-methoxyethyl.
Figure 2
Common Delivery Methods for RNA-based Therapeutics. (A) RNA-based therapeutics are often encapsulated, or attached on the surface of, nanoparticles to aid delivery of the drug into the cell. These nanoparticles are often modified with moieties such as cholesterol or polyethylene glycol (PEG) which aid uptake of the nanoparticle via the cell membrane. Some nanoparticles are directed to particular cells by the addition of a targeting moiety, often a ligand for a cell surface receptor specifically expressed on the target cell. Commonly, the nanoparticle enters the cell via endocytosis, forming an endosome, which, after environmental changes (e.g., lowered pH), degrades, releasing the RNA therapeutic into the cell. (B) Alternatively, some RNA therapeutics are directly conjugated to moieties to aid their transport across the cell membrane, e.g., cholesterol (C) Synthesized RNA therapeutics can be chemically modified to increase their stability and binding affinity and decrease their toxicity. LNA: locked nucleic acid (2?4?-methylene; 2?OMe: 2?-O-methyl; 2?MOE: 2?-O-methoxyethyl.  Figure 3
Mechanism of approved therapeutics. (A) Nusinersen regulates splicing of the Survival Motor Neuron (SMN) 2 gene to treat patients with spinal muscular atrophy (SMA). Due to weak splice site, masked by the binding of hnRNP, the SMN2 gene usually produces a truncated transcript lacking exon 7, which, when translated, produces a non-functional and unstable protein (SMN2?7). Nusinersen (SpinrazaTM, Biogen) is an antisense oligonucleotide (ASO) therapy that binds, via complementarity, to SMN2 pre-mRNA, displacing hnRNP, exposing the splice site and increasing the inclusion of exon 7, forming a full-length, mature SMN2 transcript. Once translated, this produces a full-length, functional SMN protein, which improves patient’s motor neuron function and slows disease progression. (B) Patisiran (Onpattro) reduces the production of transthyrethin (TTR) protein to reduce the formation of amyloid fibrils in hereditary transthyretin-mediated (hATTR) amyloidosis. Mutations in the TTR gene causes misfolding of the TTR protein, the misfolded protein aggregates into amyloid fibrils. Patisiran is a synthesized siRNA therapy, which is 100% complementary to a specific sequence in the 3? UTR of the TTR mRNA. Once Patisiran enters the cell, one strand of the short interfering RNA (siRNA) duplex is loaded onto an Ago2 protein, forming RISC. RISC binds to the TTR transcript, which is subsequently cleaved by Ago2, therefore reducing TTR protein production, preventing further amyloidosis and improving patient’s quality of life.
Figure 3
Mechanism of approved therapeutics. (A) Nusinersen regulates splicing of the Survival Motor Neuron (SMN) 2 gene to treat patients with spinal muscular atrophy (SMA). Due to weak splice site, masked by the binding of hnRNP, the SMN2 gene usually produces a truncated transcript lacking exon 7, which, when translated, produces a non-functional and unstable protein (SMN2?7). Nusinersen (SpinrazaTM, Biogen) is an antisense oligonucleotide (ASO) therapy that binds, via complementarity, to SMN2 pre-mRNA, displacing hnRNP, exposing the splice site and increasing the inclusion of exon 7, forming a full-length, mature SMN2 transcript. Once translated, this produces a full-length, functional SMN protein, which improves patient’s motor neuron function and slows disease progression. (B) Patisiran (Onpattro) reduces the production of transthyrethin (TTR) protein to reduce the formation of amyloid fibrils in hereditary transthyretin-mediated (hATTR) amyloidosis. Mutations in the TTR gene causes misfolding of the TTR protein, the misfolded protein aggregates into amyloid fibrils. Patisiran is a synthesized siRNA therapy, which is 100% complementary to a specific sequence in the 3? UTR of the TTR mRNA. Once Patisiran enters the cell, one strand of the short interfering RNA (siRNA) duplex is loaded onto an Ago2 protein, forming RISC. RISC binds to the TTR transcript, which is subsequently cleaved by Ago2, therefore reducing TTR protein production, preventing further amyloidosis and improving patient’s quality of life.