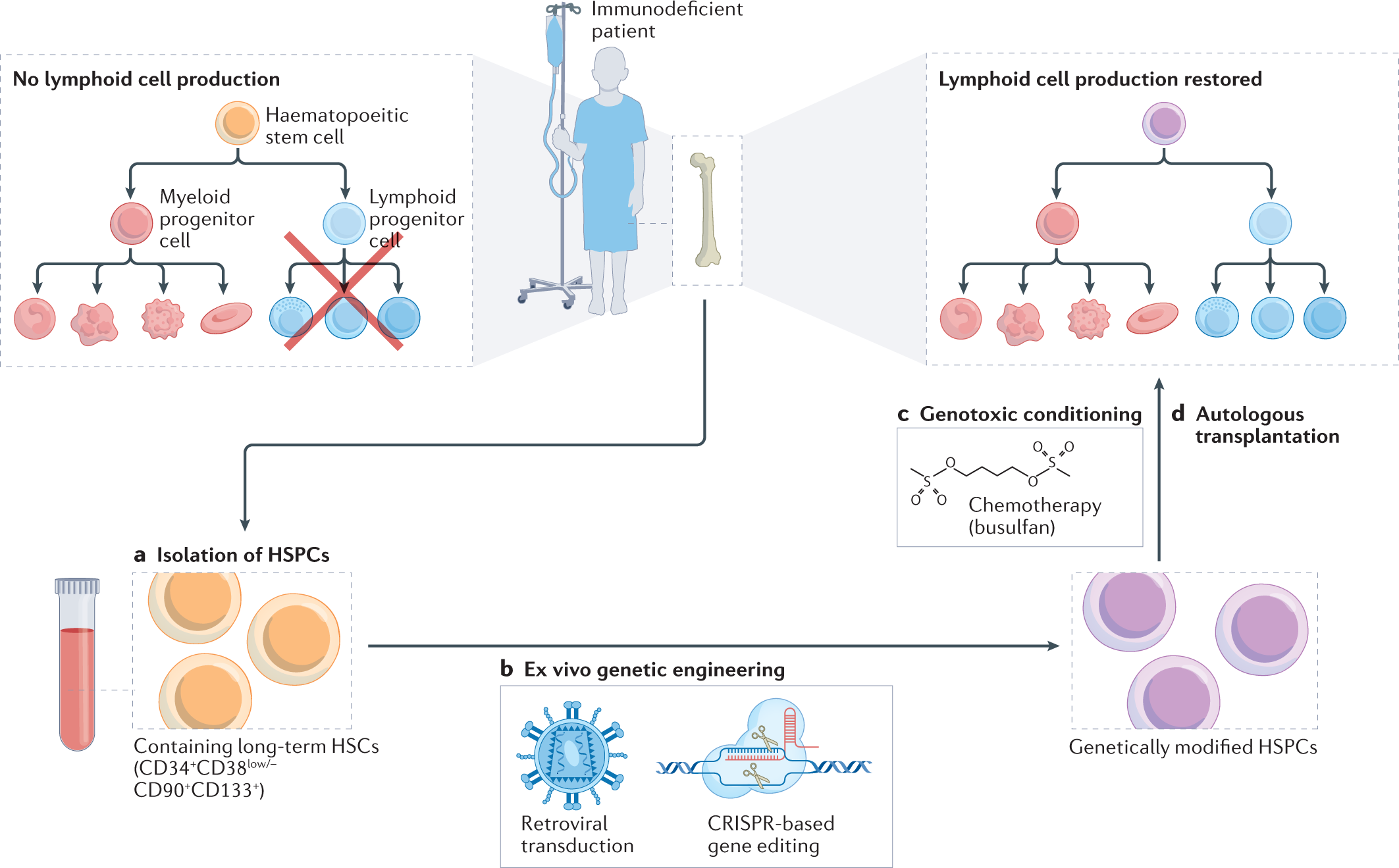
Редкая популяция клеток костного мозга, известная как гематопоэтические стволовые клетки (HSCs ), отвечает за поддержание гомеостаза кровеносной и иммунной систем на протяжении всей жизни. HSCs достигают этого благодаря своим уникальным способностям к самообновлению и мультипотентной дифференцировке1-3. В результате генетические мутации в HSCs (наследственные или соматические) проявляются в широком спектре фенотипов заболеваний, некоторые из которых непосредственно влияют на функцию HSCs , но большинство - на их дифференцированное потомство. Таким образом, поскольку мутации в HSCs являются первопричиной многих генетических гематологических заболеваний, исправление этих вызывающих болезнь мутаций в HSCs может быть терапевтическим.
По мере углубления нашего понимания HSCs и подходов генной инженерии, новые стратегии инженерии HSCs вызвали значительный интерес к использованию генотерапии на основе HSCs для лечения широкого спектра заболеваний. Например, новые методы трансплантации HSCs без необходимости применения генотоксичных режимов кондиционирования, повреждающих ДНК (вставка 2), позволят расширить применение генной терапии на основе HSCs за пределы самых тяжелых генетических заболеваний, угрожающих жизни, и стать потенциальным долгосрочным методом лечения клинически управляемых заболеваний, таких как аутоиммунная гемолитическая анемия15. Кроме того, совершенствование культуры HSCs ex vivo открывает возможности для более сложных протоколов генной инженерии и селекции, а также масштабируемых готовых продуктов HSCs, расширяя тем самым доступ пациентов к этой терапии16-18. Кроме того, достижения в области генной инженерии должны позволить использовать новые стратегии лечения, такие как генная терапия HSCs in vivo.
Однако, чтобы полностью реализовать потенциал терапии на основе HSCs для более широкого спектра заболеваний, необходимо решить многочисленные иммунологические проблемы. Врожденные и адаптивные иммунные реакции на реагенты для генотерапии остаются значительным потенциальным барьером для эффективности этих платформ. Более того, возможность иммунных реакций
in vivo на неоантигены, введенные в HSCs с помощью процедур редактирования генов, еще предстоит изучить в клинических исследованиях. В данном обзоре мы обобщаем последние достижения в области генотерапии на основе HSCs и выделяем иммунологические проблемы, которые необходимо преодолеть для успеха как существующих технологий, так и технологий следующего поколения.
Вставка 1
Платформы генной инженерии для гемопоэтических стволовых клеток
Первой платформой, успешно использованной для генной терапии гемопоэтических стволовых клеток (HSCs ), было применение интегрирующих ретровирусов для введения экзогенных трансгенов в HSCs . Эти ретровирусные платформы используют естественную способность как ретровирусов, так и лентивирусов трансдуцировать HSCs , обходить внутриклеточные врожденные иммунные реакции и вводить генетические элементы в геном хозяина. Удаляя вирусные генетические элементы и заменяя их интересующим трансгеном, экзогенные трансгены могут быть включены в геном хозяина полу-случайным образом (рис. 3). На сегодняшний день в Европейском Союзе одобрена ретровирусная генотерапия дефицита аденозиндеаминазы - тяжелого комбинированного иммунодефицита (ADA-SCID) (торговое название Strimvelis) и лентивирусная генотерапия β-талассемии (betibeglogene autotemcel; торговое название Zynteglo), а лентивирусная генная терапия HSCs для 20 различных заболеваний в настоящее время проходит I-III фазы клинических испытаний в Европейском Союзе или в США144 (Таблица 1). Однако опасения по поводу безопасности, связанные с полу-случайной схемой геномной вставки этих векторов, послужили толчком к разработке платформ генного редактирования, которые позволяют осуществлять сайт-специфическую инженерию генома. Платформы редактирования генов, такие как система CRISPR-Cas9, в основном предполагают создание специфического двунитевого разрыва в ДНК для стимулирования геномных изменений путем манипулирования клеточной репарацией двунитевого разрыва - либо путем соединения негомологичных концов, либо путем гомологически направленной репарации (рис. 3). Также были разработаны платформы редактирования генов нового поколения, которые не зависят от генерации двунитевого разрыва (который может вызвать нежелательные геномные перестройки). Например, редакторы оснований позволяют изменять один нуклеотид в геноме, а праймер-редактирование может способствовать изменению последовательности до 40 п.н. в геноме154 (рис. 3). До настоящего времени серповидно-клеточная болезнь и β-талассемия были основными целями для клинического применения технологий редактирования генов в HSCs . О первом клиническом испытании I фазы генной терапии HSCs на основе CRISPR-Cas9 для лечения серповидноклеточной болезни и β-талассемии было сообщено в 2021 году, и многие другие клинические испытания уже проводятся или находятся в стадии разработки11 (табл. 1).
|
|
Box 2 Conditioning regimens for haematopoietic stem cell transplantation
Для облегчения приживления гемопоэтических стволовых клеток (HSCs ) после трансплантации HSCs (HSCT ) в настоящее время стандартом является использование генотоксического кондиционирования (химиотерапии или радиотерапии). При аллогенной HSCs пациентам пересаживают HSCs , полученные от здоровых доноров-людей с иммунологически подобранными маркерами антигенов лейкоцитов человека (HLA; MHC). В этих условиях обычно используется тотальное облучение тела или химиотерапевтическое кондиционирование для уничтожения эндогенных HSCs и адаптивной иммунной системы (лимфоаблация), чтобы создать пространство для приживления HSCs в нише HSCs и предотвратить отторжение трансплантата адаптивной иммунной системой хозяина155. Однако тотальное облучение организма является высокотоксичным для пациентов, а при аутологичной HSCT лимфоаблация не обязательно требуется, поскольку трансплантируемые клетки получены от пациента и, таким образом, полностью иммунологически подобраны как по HLA-маркерам, так и по минорным антигенам. Эти различные требования привели к разработке альтернативных схем кондиционирования для аутологичной генной терапии HSCs , которые в основном были направлены на использование химиотерапевтического бусульфана для облегчения приживления трансплантированных HSCs без лимфоаблации120. Бусульфан является алкилирующим агентом, который создает поперечные связи ДНК, вызывая генотоксический стресс в клетках, к которому HSCs значительно более чувствительны, чем другие типы клеток, например, клетки адаптивной иммунной системы. |
Immunity to gene-therapy reagents
Разработка инструментов для эффективного генетического манипулирования HSCs должна учитывать как внутриклеточные сигнальные пути врожденной иммунной системы, так и ответы адаптивной иммунной системы (рис. 4). Для подходов гентерапии
ex vivo (вставка 1) врожденные иммунные сигнальные пути в HSCs были основным препятствием для эффективной генной коррекции; однако по мере приближения к реализации генотерапии HSCs
in vivo необходимо учитывать и адаптивные иммунные реакции против реагентов генотерапии.

Fig. 4: Immune barriers in haematopoietic stem cell gene therapy.
Gene therapy of haematopoietic stem cells (HSCs) is challenged by various immune barriers of both innate and adaptive immune systems.
a | Innate immune pathways that detect gene-therapy reagents include double-stranded DNA (dsDNA)-sensing pathways such as those mediated by Toll-like receptor 9 (TLR9) (not shown) and the cGAS-STING pathway; DNA damage response pathways such as through the kinase ATM and p53, which allow for detection of viral episomal DNA in the nucleus; RNA-sensing pathways such as through TLR3, TLR7, TLR8 and TLR13, or through retinoic acid-inducible gene I (RIG-I)-like receptors (RLRs), that allow for detection of synthetic or viral RNA; and pathways that allow for the detection of xenogeneic contaminants that can be present when gene-editing reagents such as Cas9 are produced in xenogeneic hosts, such as lipopolysaccharide (LPS) which can be detected by TLR4. The ability of HSCs to digest proteins via the proteasome and to present peptides from these proteins on MHC class I molecules is also shown.
b | The adaptive immune system can also present significant challenges to the genetic engineering of HSCs, either when genetically edited cells are transplanted back into a patient or, potentially, if genetic engineering reagents were delivered to cells in vivo. T cells can recognize cells containing foreign proteins (either neoantigens introduced into HSCs or proteins used to genetically engineer them) through interaction with antigen-presenting MHC class I molecules, which leads to T cell activation and destruction of the genetically modified cell. Antibodies produced by B cells can neutralize viral vectors or gene-therapy proteins present in the bloodstream. AAV, adeno-associated virus; IFNγ, interferon-γ; TCR, T cell receptor; TNF, tumour necrosis factor.
Innate immunity to lentiviruses
HSCs экспрессируют различные pattern recognition receptors (PRRs), которые позволяют им обнаруживать и реагировать на чужеродные патогены или эндогенные повреждения посредством распознавания консервативных патоген-ассоциированных молекулярных паттернов или c повреждениями ассоциированных молекулярных паттернов, соответственно19. К таким PRR относятся Toll-подобные рецепторы (TLR), которые распознают чужеродные молекулы на клеточной мембране, в эндосомах и лизосомах, ретиноевая кислота-индуцибельный ген I (RIG-I)-подобные рецепторы (RLR), которые распознают чужеродную РНК, и ДНК-сенсоры, такие как путь cGAS-STING, которые распознают чужеродную ДНК. В результате любые реагенты для генотерапии должны быть разработаны и доставлены для HSCT таким образом, чтобы свести к минимуму активацию сигнальных путей, опосредованных PRR. Эти пути и связанные с ними проблемы генной инженерии были подробно рассмотрены в других источниках19,20 , поэтому здесь мы лишь кратко подытожим их.
Лентивирусы, один из видов ретровирусов, стали идеальными векторами для генотерапии на основе HSCs , поскольку ретровирусы выработали многочисленные механизмы, позволяющие избегать обнаружения в клетках со стороны врожденного иммунитета (рис. 3 и 4). Например, 5' capping вирусной РНК предотвращает активацию RLR-сигнализации, а прямой ядерный импорт вирусного генома минимизирует активацию cGAS-STING в цитоплазме21,22. Тем не менее, лентивирусы не полностью избегают внутриклеточных иммунных ответов. Например, было показано, что присутствие лентивирусной ДНК в ядре вызывает активацию киназы ATM, которая участвует в обнаружении свободных концов двухцепочечной ДНК (dsDNA) или коротких одноцепочечных нависаний ДНК. Лентивирусная активация ATM приводит к активации р53 в HSCs , что приводит к активации мишеней р53, таких как ингибитор циклин-зависимой киназы р21, и к аресту клеточного цикла или апоптозу HSCs , что, как было показано, снижает потенциал приживления трансдуцированных HSCs по меньшей мере в 2 раза23. Кроме того, HSCs и другие стволовые клетки крайне неустойчивы к лентивирусной трансдукции, отчасти потому, что они конститутивно экспрессируют большое количество рестрикционных факторов по сравнению с более дифференцированными типами клеток; например, HSCs экспрессируют высокий уровень интерферон-индуцированного противовирусного белка IFITM1 (ссылка 24). Таким образом, лучшее понимание врожденных иммунных путей, запускаемых лентивирусами, и способов их ингибирования будет иметь важное значение для разработки более эффективных протоколов лентивирусной генотерапии как за счет увеличения приживления, так и за счет увеличения трансдукции. Например, было показано, что ингибирование p53 увеличивает приживление лентивирусных HSCs за счет блокирования ATM-опосредованной передачи сигналов, а циклоспорин H увеличивает лентивирусную трансдукцию HSCs в 10 раз за счет снижения экспрессии IFITM123,25. Дальнейшие исследования путей лентивирусной трансдукции, вероятно, позволят найти еще более перспективные решения для повышения эффективности лентивирусной генной инженерии HSCs .
Innate immunity to gene-editing enzymes
В отличие от генотерапии на основе лентивирусов, которые используют преимущества естественного жизненного цикла вируса для проникновения в клетку и ее генной инженерии, редактирование генов требует введения в HSCs реагентов, которые не могут проникнуть в них естественным путем. Электропорация стала простым методом введения чужеродных реагентов для редактирования генов в HSCs11. ДНК-векторы обычно используются для генной инженерии клеточных линий, но их применение в первичных клетках приводит к активации PRR-путей, таких как путь cGAS-STING, dsDNA в цитоплазме. Чтобы избежать активации ДНК-чувствительных путей в HSCs , современные методы редактирования генов избегают компонентов ДНК и вместо этого полагаются на доставку РНК, белка или рибонуклеопротеиновых комплексов в случае платформ на основе CRISPR (белок Cas9 в комплексе с синтетической одиночной направляющей РНК (sgRNA)). Однако синтетическое или ксеногенное происхождение этих реагентов может привести к активации PRR-опосредованной сигнализации в HSCs . Например, было показано, что синтетические мРНК вызывают врожденный клеточный иммунный ответ в HSCs, что приводит к повышению уровня цитокинов, таких как интерферон-γ (IFNγ). Врожденное иммунное распознавание мРНК может быть ослаблено включением псевдоуридина вместо уридина, модификацией 5-метилцитозина или истощением уридина26-29. Аналогичным образом, было показано, что транскрибированные in vitro sgRNA вызывают значительные врожденные иммунные реакции в HSCs , которые могут быть ослаблены химическим синтезом и модификацией sgRNA 2?'-О-метил-3'-фосфоротиоатом30,31. Было показано, что доставка ферментов для редактирования генов в виде белка не вызывает значительного врожденного иммунного ответа в клетках; однако, если белок для редактирования генов производится в ксеногенном хозяине, требуется строгая очистка, чтобы минимизировать активацию передачу сигналов TLR4 загрязняющими веществами, такими как липополисахариды (LPS)18. Кроме того, потенциальное влияние новых платформ редактирования генов, таких как редакторы оснований и праймер-редактирование, на пути врожденного иммунитета еще предстоит изучить на HSCs 32,33.
Innate immunity to DNA donors
По сравнению с доставкой ферментов для редактирования генов, доставка ДНК-донора для стимулирования гомологически направленной репарации в HSCs оказалась гораздо более сложной иммунологической задачей, поскольку голые молекулы dsDNA могут запускать PRR-пути, такие как путь cGAS-STING в HSCs , что приводит к гибели клеток34 (вставка 1; рис. 4). Поэтому были изучены альтернативные методы доставки донорских шаблонов ДНК, в первую очередь, на основе вирусных векторов, поскольку они эволюционировали, чтобы избежать внутриклеточного врожденного иммунного ответа (рис. 3). Клинически значимые уровни гомологически направленной репарации в HSCs были достигнуты сначала с помощью не-интегрирующих лентивирусных векторов, а затем с помощью векторов адено-ассоциированного вируса (AAV)35-37. В HSCs AAV6 оказался особенно эффективным для стимулирования гомологически направленной репарации, и в конце этого года ожидается начало клинических испытаний с использованием AAV6 для исправления мутаций в гене гемоглобина-β (HBB) у пациентов с серповидноклеточной болезнью (ClinicalTrials.gov NCT04819841). Однако было показано, что векторы AAV активируют сигналы TLR2 и/или TLR9 в клетках, а также ответы на повреждение ДНК, включающие сигналы ATM и активацию p53 в HSCs (также наблюдается и при лентивирусной трансдукции), что приводит к снижению приживления HSCs после вирусной трансдукции23,38-40. Альтернативными источниками донорских шаблонов ДНК являются одноцепочечные олигодезоксинуклеотиды (ssODN), которые обладают ограниченной иммуногенностью, но в настоящее время могут доставлять только относительно короткие последовательности ДНК (≤200 bp)41. Дальнейшее изучение путей врожденного иммунитета, запускаемых векторами AAV и ssODNs, вероятно, приведет к улучшению эффективности генотерапии.
Adaptive immune challenges
Поскольку многие реагенты, используемые для генной инженерии HSCs , имеют ксеногенное происхождение, они могут быть распознаны нашей адаптивной иммунной системой. Современная парадигма генотерапии с помощью HSCs сосредоточена на доставке реагентов генотерапии в аутологичные HSCs ex vivo с последующей их трансплантацией обратно пациенту, получившему генотоксическое кондиционирование. Поскольку эти реагенты доставляются ex vivo, их воздействие на адаптивную иммунную систему сводится к минимуму, и адаптивные иммунные реакции на реагенты генотерапии до сих пор не были серьезным препятствием для клинической эффективности генотерапии с помощью HSCs ex vivo11-14. Однако, по мере развития генотерапии HSCs , усилия по разработке генотерапии HSCs in vivo приобрели значительный исследовательский интерес. Для того чтобы генотерапия HSCs in vivo была успешной, необходимо тщательно продумать возможные побочные реакции на реагенты для генотерапии, доставленные in vivo.
Доставка реагентов для редактирования генов in vivo, как в животных моделях, так и у людей, может привести к их нейтрализации во внеклеточной среде антителами. Кроме того, любые реагенты, доставленные внутриклеточно в виде белка, могут быть расщеплены на пептиды и представлены на молекулах MHC класса I цитотоксическим Т-клеткам, это потенциально может привести к опосредованной Т-клетками цитотоксичности против генетически модифицированных клеток42-45 (рис. 4). Если нет уже существующего иммунитета к реагентам для редактирования генов, данные, полученные на животных моделях и клинический опыт испытаний генотерапии in vivo (не на HSCs ), показывают, что преходящее воздействие этих реагентов вряд ли приведет к неблагоприятному иммунному ответу из-за времени, необходимого для формирования надежного адаптивного иммунного ответа против чужеродного антигена45-48. Однако, как только сформируется адаптивная иммунная память о реагентах для редактирования генов, адаптивная иммунная система может быстро отреагировать на их последующее использование44,46,49.
Предсуществующий иммунитет до сих пор является серьезной проблемой для применения генотерапии in vivo в доклинических и клинических исследованиях, что приводит к полному подавлению терапевтического эффекта44,45,48,49. В то время как предсуществующий иммунитет к лентивирусным векторам встречается редко, предсуществующий иммунитет к векторам AAV (присутствует у ~30-60% взрослых) и к системе CRISPR-Cas9 (присутствует у ~60% взрослых) распространен в человеческой популяции вследствие контакта с патогенами, из которых получены эти платформы, причем частота и уровень иммуногенности зависит от серотипа или вида происхождения реагента50-53. Даже в тех случаях, когда у пациента нет предсуществующего иммунитета к реагентам генного редактирования, воздействие адаптивной иммунной системы на эти реагенты в рамках генотерапии может привести к развитию реакций иммунной памяти, которые предотвращают возможность повторного дозирования или применения реагентов генотерапии в будущем для того же пациента44,54,55. Примечательно, что проблема предсуществующего иммунитета наблюдалась в клинических испытаниях аутологичной генотерапии HSCs ex vivo. Недавние клинические испытания HSCs , созданных ex vivo с помощью псевдо-типированных лентивирусных векторов VSV-G, выявили развитие адаптивного иммунного ответа против VSV-G после HSCT у людей, что указывает на то, что адаптивная иммунная система может распознавать и реагировать на реагенты генного редактирования in vivo, даже если они были применены к клеткам в условиях ex vivo56. Кроме того, загрязнения, возникающие в процессе производства реагентов для генотерапии, также могут привести к нежелательным адаптивным иммунным реакциям. Например, лентивирусные векторы могут включать молекулы HLA в свою вирусную оболочку при производстве в клеточной линии, если только не используется клеточная линия, свободная от аллоантигенов57. Эти загрязняющие молекулы HLA могут привести к нейтрализации вектора антителами или клиренсу трансдуцированных клеток Т-клетками.
Immunity to HSC neoantigens
Даже если реагенты генной инженерии могут быть применены к HSCs , не вызывая иммунного ответа против них, успешная трансплантация и/или выживание in vivo модифицированных HSCs представляет собой иммунологическую проблему для успешной генотерапии. Модификация генома HSCs либо путем исправления мутаций, вызывающих заболевания, либо с помощью терапии, включающей введение трансгенов, может привести к экспрессии неоантигенов, что создает риск адаптивных иммунных реакций против генно-инженерных клеток и их выведения из организма (рис. 4).
Возможность того, что неоантигены, введенные в рамках генотерапии, могут вызвать адаптивный иммунный ответ против генно-инженерных клеток, была продемонстрирована в многочисленных доклинических исследованиях на HSCs и других системах органов, а также в клинических исследованиях (хотя клинические испытания на основе HSCs еще не проводились)58-65. Однако уникальным аспектом генотерапии HSCs является то, что lymphoablation (вымывание с помощью лимфы) может быть проведена до HSCT для облегчения толерантности к неоантигенам, введенным с помощью генотерапии; в этом случае иммунная система, восстановленная из трансплантированных HSCs , проходит отрицательный отбор in vivo на реактивность против самоантигенов, включая неоантигены, для обеспечения центральной толерантности66-68. Тем не менее, лимфоаблация имеет существенные ограничения, включая полную потерю иммунной памяти, что делает пациентов временно иммуносупрессивными и подвергает их риску оппортунистических или латентных инфекций69,70. Кроме того, лимфоаблация становится менее целесообразной с возрастом из-за фиброза тимуса и значительно сниженной способности к восстановлению иммунной системы после лимфоаблации71,72. Эти ограничения побудили к проведению исследований в области не-лимфоаблативного генотоксического кондиционирования, что повышает вероятность антиген-специфического иммунного ответа против генетически модифицированных HSCs при проведении HSCT в отсутствие лимфоаблации.
Зеленый флуоресцентный белок (GFP) часто используется в качестве модельного антигена для изучения эффекта введения ксеногенов в HSCs . Исследования показали развитие В-клеток и Т-клеток, специфичных по GFP, после HSCT в моделях мышей и не-человекообразных приматов после нелимфоаблативного генотоксического кондиционирования, что в конечном итоге привело к отторжению пересаженных клеток во многих исследованиях61-64. Примечательно, что некоторые группы сообщили, что преходящая пост-трансплантационная иммуносупрессия (с помощью таких препаратов, как рапамицин, циклоспорин и абатацепт) может смягчить развитие адаптивных иммунных реакций и вызвать толерантность к введенным антигенам, что позволяет вводить ксеноген экспрессирующие HSCs без иммунного отторжения у мышей, собак и не-человекообразных приматов61,73,74. Более того, в некоторых исследованиях долгосрочное приживление HSCs, экспрессирующих GFP, было достигнуто без лимфоаблации или иммуносупрессии75. Эти неоднозначные результаты, касающиеся толерантности к ксеногенам, подчеркивают необходимость дальнейшего изучения иммунного ответа против введенных трансгенов в различных условиях кондиционирования HSCs , особенно по мере того, как новые негенотоксичные методы кондиционирования начинают входить в клиническую практику.
Аллогенная или аутологичная HSCT может быть целебной для аутоиммунных заболеваний, если она проводится в контексте лимфоаблации, предположительно благодаря тому, что лимфоаблация перезагружает иммунную память и очищает организм от аутореактивных В- и Т-клеток76. Более того, было показано, что введение и экспрессия антигенов в HSCs или введение профессиональных антиген-презентирующих клеток (АПК), которые дифференцируются из HSCs , вызывают толерантность в мышиных моделях аутоиммунитета, даже без лимфоаблации перед HSCT77,78. Примечательно, что презентация антигенов APCs на молекулах MHC класса II в отсутствие воспаления играет важную роль в поддержании периферической толерантности и может объяснить, почему введение антигенов в HSCs и их презентация APCs, дифференцирующимися из HSCs , может быть толерантной79. Эти исследования генотерапии HSCs для лечения аутоиммунных заболеваний подчеркивают потенциал генотерапии HSCs для специфической толерантности иммунной системы к чужеродным антигенам и могут объяснить некоторые противоречивые результаты относительно толерантности к ксеногенам после HSCT. Однако стоит также отметить, что генотоксическое кондиционирование, как было показано, вызывает значительное воспаление, которое может стимулировать иммунную систему к отторжению трансплантированных клеток, экспрессирующих ксеногены80-82. Это может помочь объяснить, почему использование иммуносупрессии способствует индукции толерантности к ксеногенам, введенным в HSCs , поскольку это дает время для уменьшения воспаления после HSCs и для дифференцировки APC, экспрессирующих ксеногены, от трансплантированных HSCs . Однако четкий ответ относительно иммунитета или толерантности к ксеногенам, экспрессируемым HSCs in vivo, требует дальнейшего изучения.
По сравнению с ксеногенами риск развития адаптивных иммунных реакций против эндогенных генов, вновь введенных (для коррекции генов) в HSCs, ниже61,83,84. Вероятно, это объясняется тем, что здоровый эндогенный генный продукт и мутировавший генный продукт имеют идентичные или почти идентичные антигены. Однако чем сильнее мутация в эндогенном гене, тем сильнее должен быть адаптивный иммунный ответ на исправленный генный продукт. Например, было показано, что распространенность адаптивного иммунного ответа против фактора VIII, который используется в enzyme replacement therapy (ERT) путем внутривенной инфузии для пациентов с гемофилией, сильно коррелирует с расположением генетических мутаций у пациентов, проходящих лечение; у пациентов с генетическими мутациями, приводящими к полной отмене экспрессии фактора VIII, вероятность развития ингибирующих антител к ERT в семь-десять раз выше, чем у пациентов с более легкими генетическими дефектами (такими как небольшие делеции или мутации участков сплайсинга)85. Примечательно, что у пациентов часто развивается адаптивный иммунный ответ на белки, вводимые с помощью ERT, такие как лизосомный фермент α-L-идуронидаза (IDUA), который используется для лечения мукополисахаридоза типа 1 (MPS1)85,86. Уже существующий адаптивный иммунитет к IDUA (вследствие ERT) привел к удалению генетически модифицированных HSCs в мышиной и собачьей моделях MPS1, а лимфоаблация является единственным известным методом обеспечения приживления HSCs в условиях уже существующего иммунитета против антигена, введенного в рамках генотерапии HSCs 83,87.
К счастью, до сих пор в клинических испытаниях генотерапии HSCs не было зарегистрировано никаких неблагоприятных иммунных реакций на неоантигены. Однако клиническое применение генотерапии HSCs до сих пор было направлено на коррекцию иммунодефицитов, метаболических нарушений или гемоглобинопатий, при которых пациенты имеют ослабленную иммунную систему или получили функциональную копию эндогенного гена. Более того, в случаях, когда у пациентов уже имеется иммунитет к введенному трансгену, например, у пациентов с MPS1 вследствие предшествующей ERT, химиотерапевтическая лимфоаблация была включена как часть режима кондиционирования для предотвращения нежелательных иммунных реакций против введенных трансгенов88. Поскольку применение генотерапии выходит за рамки наиболее опасных для жизни заболеваний, для обеспечения успешного приживления генно-инженерных HSCs необходимо тщательно учитывать возможность иммунного ответа против введенных неоантигенов. Поэтому следует изучить новые методы, позволяющие избежать презентации неоантигенов APCs или вызвать специфическую толерантность к неоантигенам. Способность генотерапии HSCs вызывать толерантность к антигенам посредством транзиторной пост-трансплантационной иммуносупрессии или путем ограничения экспрессии неоантигенов на APCs предлагает один из привлекательных подходов к обеспечению толерантности без использования лимфоаблации.
Immunity to next-generation therapies
После успешного применения генотерапии HSCs для клинического лечения множества заболеваний (табл. 1), теперь можно представить себе новые способы генной инженерии HSCs , не ограничивающиеся исправлением тяжелых, угрожающих жизни мутаций. Одной из областей, обладающих исключительным потенциалом, является внедрение новых иммунных функций в гемопоэтическую систему. Например, в настоящее время ведутся работы по использованию генотерапии HSCs для придания устойчивости к ВИЧ-1 инфекции путем нокаута CCR5 (ко-рецептора для ВИЧ-1) в геноме HSCs и путем введения факторов рестрикции, малых интерферирующих РНК или системы CRISPR-Cas13 (для ингибирования жизненного цикла вируса напрямую или для нокдауна генов, участвующих в репликации ВИЧ-1)89-91. По мере совершенствования этих подходов их применение может быть распространено на другие инфекции, являющиеся основной причиной тяжести заболеваний, такие как вирус Эпштейна-Барр, цитомегаловирус или малярия. Генотерапия с помощью HSCT также была предложена в качестве способа повышения безопасности терапии лейкемии химерными антигенными рецепторами Т-клеток (CAR T-клеток). Выбивая антиген, на который нацелены CAR T клетки (например, CD33) в донорских HSCs , можно предотвратить нежелательное уничтожение донорских HSCs CAR T клетками92.
Другие будущие модификации HSCs могут включать в себя вставку последовательностей, кодирующих специфические для патогена антитела, Т-клеточные рецепторы (TCR) или CAR в рамках генотерапии для создания вакцин на основе HSCs . При введении в HSCs нужных последовательностей, специфичных для патогена, зрелые иммунные клетки, которые дифференцируются из них, могут обеспечить пожизненную защиту от болезни без необходимости иммунизации93-96. Более того, недавние эпидемии SARS-CoV, вируса Эбола и SARS-CoV-2, которые оказались очень опасными для человеческих популяций, как было показано, заражают представителей порядка Chiroptera (летучих мышей) без значительной патогенности97; поэтому лучшее понимание иммунных систем других видов может открыть потенциал для перестройки нашей собственной иммунной системы с помощью генотерапии HSCs для обеспечения большей защиты от инфекции и улучшения здоровья человека в целом.
Если выйти за рамки существующей линии генотерапии HSCs , то последние наши достижения расширять способности HSCs ex vivo, проводить негенотоксическое кондиционирование для HSCs и доставлять ферменты для редактирования генов in vivo предлагают потенциал для разработки новых парадигм генотерапии HSCs более масштабируемым, доступным и безопасным способом. Однако для успешной разработки и клинического применения этих платформ генотерапии HSCs нового поколения необходимо преодолеть несколько иммунологических барьеров, о чем речь пойдет ниже.
Off-the-shelf HSC gene therapy
С развитием протоколов экспансии человеческих HSCs и генной инженерии одна популяция генетически модифицированных HSCs может в конечном итоге стать массовым продуктом для использования в качестве готовой терапии HSCs для множества пациентов18,98-100. Кроме того, в настоящее время проводятся значительные исследования по дифференцировке HSCs из человеческих плюрипотентных стволовых клеток или трансдифференцировке других типов гемопоэтических клеток в HSCs 101-103. Хотя методы расширения и/или создания HSCs ex vivo значительно улучшат доступность HSCs , иммунологические проблемы, связанные с трансплантацией этих клеток, еще не полностью решены.
Для того чтобы готовая аллогенная генотерапия HSCs была успешной, HSCs должны прижиться без отторжения иммунной системой реципиента. Любой готовый продукт HSCs , полученный из плюрипотентной стволовой клетки или от человеческого донора, вряд ли будет полностью иммунологически соответствовать пациенту из-за высокой вариабельности аллелей HLA (в человеческой популяции известно более 15 000 различных аллелей HLA)6,104,105. Одним из возможных решений может быть генетическая инженерия ex vivo-размноженных HSCs , чтобы они полностью соответствовали любому пациенту, которому они будут пересажены, путем нокаута несовпадающих аллелей HLA; однако это необходимо проводить для каждого пациента отдельно106. Вместо этого более реальным и универсальным подходом является генетическая модификация HSCs , чтобы они стали гипоиммунными, то есть не распознавались иммунной системой. В частности, создание гипоиммунных клеток было продемонстрировано в плюрипотентных стволовых клетках путем нокаута локуса β2-микроглобулина (компонент молекул MHC класса I) и нокаута либо синтетической молекулы HLA-E, либо избыточной экспрессии анти-фагоцитарного сигнала CD47 (ссылки107,108). Нокаут β2-микроглобулина предотвращает презентацию аллогенных молекул HLA на поверхности клеток, тем самым предотвращая развитие антител к HLA и опосредованный Т-клетками лизис клеток, экспрессирующих несовпадающие HLA; а экспрессия синтетической молекулы HLA-E или CD47 предотвращает атаку естественных клеток-киллеров.
Генетически сконструированные гипоиммунные мышиные клетки оказались успешными для аллогенной трансплантации эмбриональных стволовых клеток и сердечно-сосудистых клеток между MHC-совместимыми хозяевами без отторжения107,109. Однако эти подходы еще не применялись для HSCT . Молекулы MHC (HLA) играют важную роль в развитии и функционировании иммунных клеток, а отсутствие их экспрессии путем нокаута может иметь значительные негативные последствия для общей функции иммунной системы110-112. Более того, избыточная экспрессия негативных регуляторов иммунной активации, таких как CD47, может иметь серьезные пагубные последствия для общего гемопоэза, например, путем ингибирования нормального оборота эритроцитов113. Поэтому создание клинически применимых гипоиммунных HSCs остается открытой проблемой.
Готовые HSCs от аллогенных доноров в идеале можно было бы пересаживать без необходимости лимфоаблации, которая приводит к потере иммунной памяти, или модификации HLA-локусов, что влияет на презентацию антигенов. Одним из перспективных решений может стать индукция толерантности к чужеродным HLA-генам с помощью регуляторных Т-клеток или регуляторных Т-клеток CAR, клинические испытания которых находятся в стадии завершения108,114-116. В качестве альтернативы было показано, что печень является высоко толерантной средой, и целенаправленная избыточная экспрессия ксеногенных и аллогенных HLA в этой среде (с использованием специфических для печени промоторов и микроРНК для предотвращения экспрессии в нецелевых тканях) вызывает периферическую толерантность к ним117-119. Таким образом, возможно, что эти подходы могут быть применены для облегчения трансплантации аллогенных HLA-совместимых HSCs пациентам без дополнительной негативной модификации иммунной системы.
Non-genotoxic conditioning for HSCT
Современные подходы к генотерапии HSCs обычно основаны на использовании химиотерапевтического бусульфана, алкилирующего агента, который создает поперечные связи ДНК, вызывая генотоксический стресс. HSCs значительно более чувствительны к такому генотоксическому стрессу по сравнению с другими типами клеток, такими как клетки адаптивной иммунной системы. Поэтому бусульфан удаляет эндогенные HSCs из ниши HSCs , чтобы освободить место для приживления трансплантированных генетически модифицированных HSCs без какой-либо лимфоаблации120. Однако использование такого генотоксического кондиционирования также связано со значительной токсичностью для пациентов, включая бесплодие, органную токсичность и риск вторичной злокачественной опухоли, что ограничивает применение генотерапии HSCT только самыми тяжелыми формами генетических заболеваний121. Негативные побочные эффекты режимов генотоксического кондиционирования стимулировали значительные исследования альтернативных методов, способствующих приживлению трансплантированных HSCs в организме пациента.
Многие из этих усилий были направлены на очистку эндогенных HSCs bp ниши с помощью препаратов на основе антител, нацеленных на антигены клеточной поверхности, экспрессия которых ограничена в основном HSCs и их ранними предшественниками. Из различных антител, разработанных к настоящему времени, наибольший интерес вызвали те, которые нацелены на CD117. Анти-CD117 кондиционирование уже вошло в клинику для аллогенной HSCT, но еще не использовалось для генно-инженерных HSCs122. Было разработано несколько оптимизированных стратегий очистки эндогенных ниш HSCs с использованием анти-CD117, включая комбинированный подход с использованием анти-CD117 и анти-CD47 для облегчения фагоцитоза, опосредованного макрофагами; анти-CD117, конъюгированный с ингибитором синтеза белка saporin для облегчения лекарственной цитотоксичности; и CAR Т-клетки, нацеленные на CD117-экспрессирующие клетки для облегчения Т-клеточной цитотоксичности15,123,124. Поскольку эти подходы специфически истощают HSCs , они должны позволить трансплантацию ген-модифицированных HSCs без ущерба для иммунной системы.
Совсем недавно использование антителами опосредованного кондиционирования для HSCT было усовершенствовано для облегчения антителами опосредованной лимфоаблации с помощью комбинации антител к CD117, CD47, CD4, CD8, CD40L и CD122, что позволяет трансплантировать HSCs от полностью иммунологически несовместимых доноров без отторжения трансплантата125. Здесь имеется захватывающий потенциальный синергизм с готовыми аллогенными HSCs , описанными выше. Однако важно понять, как использование таких негенотоксических методов изменяет иммунный ответ на пересаженные HSCs и как изменяется иммунная память после истощения иммунитета, опосредованного антителами.
Также были предложены альтернативные негенотоксические стратегии кондиционирования. Например, наша группа показала на мышах, что истощение аминокислоты валина приводит к потере HSCs в костном мозге и способствует высокому уровню приживления трансплантированных HSCs126. Хотя полное исключение валина из рациона может оказаться неприменимым в клинических условиях, это исследование подчеркивает, что дальнейшее изучение метаболизма HSCs может открыть новые пути для негенотоксического кондиционирования при HSCT. Более того, недавние исследования также показали, что надежное (более 10%) приживление HSCs без какого-либо кондиционирования возможно при внутривенной трансплантации сверхфизиологического количества HSCs (более 400% от общего числа HSCs ) мышам18,127,128.
Недавно также было продемонстрировано доказательство концепции генотерапии HSCs без кондиционирования; клиническое исследование показало, что HSCs , скорректированные генами, могут приживляться без кондиционирования у пациентов с анемией Фанкони, хотя и на низком уровне129. У этих пациентов имеются дефекты в репарации повреждений ДНК, что приводит к прогрессирующей недостаточности костного мозга. Считается, что это позволяет приживлять HSCs без кондиционирования и что генотерапия дает сильное селективное преимущество исправленным HSCs после приживления. К сожалению, в настоящее время этот подход трудно воспроизвести в других случаях заболевания, когда генная коррекция не обеспечивает такого сильного селективного преимущества без увеличения количества донорских HSCs . Для достижения этой цели наша лаборатория успешно продемонстрировала протокол, позволяющий в течение месяца в 900 раз увеличить количество HSCs мыши ex vivo, и показала, что эти ex vivo-размноженные HSCs поддаются некондиционированной трансплантации, а также генной инженерии18,127,130. Дальнейшее изучение экспансии человеческих HSCs ex vivo откроет возможность некондиционированной трансплантации в клинических условиях. Однако остаются нерешенными вопросы, касающиеся клональности прижившихся клеток, места приживления HSCs , долговечности приживления и возможности неблагоприятных событий из-за низкого уровня приживления исправленных клеток при различных заболеваниях. Было показано, что некондиционированная трансплантация гемопоэтических стволовых и клеток предшественников (HSPC) вызывает лейкемию в мышиных моделях SCID-X1 из-за репликативного стресса, с которым сталкиваются клетки предшественники после низкого уровня приживления HSCs или восстановления только предшественников. Эти исследования демонстрируют возможность непредвиденных неблагоприятных событий при проведении не-кондиционированной HSCT в клинических условиях; следует отметить, что в этих исследованиях мышам пересаживали субфизиологическое количество HSCs , что приводило к низкому или отсутствию долгосрочного приживления в костном мозге29,131.
Необходимы дальнейшие исследования того, как тип режима кондиционирования определяет иммунный ответ при аутологичной генотерапии HSCs , поскольку уровень активности врожденного и адаптивного иммунитета у пациента может влиять на степень переносимости или отторжения неоантиген экспрессирующих HSCs . Например, миелоаблативные режимы кондиционирования, такие как использование тотального облучения организма или бусульфана, являются высоко генотоксичными и вызывают значительное воспаление, создавая условия, которые, скорее всего, вызовут иммунную реактивность к неоантигенам, а не толерантность80-82. Напротив, негенотоксичные режимы кондиционирования вызывают гораздо меньшую гибель клеток, что должно снизить уровень воспаления в микроокружении костного мозга HSCs . Поэтому трансплантация HSCs, экспрессирующих неоантиген, в невоспалительную среду может быть более благоприятной для индуцирования толерантности к неоантигенам, чем трансплантация в традиционную миелоаблативную кондиционированную среду, хотя это еще предстоит изучить.
In vivo gene therapy of HSCs
В качестве альтернативы пересадке HSCs , подвергшихся генной модификации, пациенту, возможно, удастся генетически модифицировать HSCs in vivo. Генотерапия HSCs in vivo позволит избежать необходимости выделения, редактирования и HSCT и может произвести революцию в лечении и терапии гематологических заболеваний. Хотя генотерапия in vivo хорошо разработана для воздействия на другие системы органов, такие как печень, мышцы и глаза132,133 , ее применение к HSCs было относительно неразвитым из-за существования установленных протоколов для генотерапии HSCs ex vivo; таким образом, лучшие доказательства, которые мы имеем относительно потенциальных иммунных осложнений, получены из этих других систем. В настоящее время для генотерапии in vivo предложено два основных подхода: использование вирусных векторов, разработанных для экспрессии желаемых генов или реагентов для редактирования генов в клетках in vivo; или доставка мРНК или белка, заключенных в наночастицы, для введения реагентов для редактирования генов в клетках in vivo.
Вирусно-векторная генотерапия является наиболее клинически хорошо разработанной из платформ для генотерапии in vivo и доказала свою эффективность в лечении генетических заболеваний глаз и печени132,133. Несколько вирусных платформ (включая аденовирусные, AAV и лентивирусные векторы) могут трансдуцировать HSCs in vivo с разным уровнем эффективности16,134,135. Аденовирусные векторы были использованы для успешной трансдукции HSCs in vivo и обеспечения фенотипического улучшения заболевания в мышиных моделях серповидноклеточной болезни16. Также было показано, что векторы AAV способны корректировать гены in vivo с лечебной эффективностью в HSCs мышей (5-40% корректируемых HSCs)134.
В отличие от вирусных векторов, которые часто остаются в клетках надолго и используют потенциально онкогенные промоторы для экспрессии трансгенов, использование наночастиц для доставки реагентов для редактирования генов в HSCs в виде мРНК или белка является привлекательной альтернативой, поскольку преходящая экспрессия этих реагентов снижает риск онкогенеза. Например, липидные наночастицы, содержащие мРНК или белок, доказали свою высокую эффективность для редактирования генов клеток печени in vivo как в исследованиях на животных, так и в клинических испытаниях на людях, а последние доклинические данные позволяют предположить, что человеческие HSCT акже могут исполдьзовать наночастицы in vivo, по крайней мере, в пределах иммунодефицитных мышей NSG (NOD-scid Il2rgnull mice)17,136. Кроме того, несколько групп работали над доставкой системы CRISPR-Cas9 in vivo в виде рибонуклеопротеина путем добавления к белку Cas9 нескольких последовательностей ядерной локализации или с помощью проникающих в клетки пептидов137,138.
Однако успешное применение генотерапии in vivo осложняется возможностью возникновения врожденных и адаптивных иммунных реакций против реагентов генотерапии (см. ранее обсуждение этих вопросов). Например, аденовирусные векторы и векторы AAV ранее приводили к смерти пациентов в клинических испытаниях из-за системных врожденных воспалительных реакций и токсичности врожденного иммунитета, соответственно139,140. Кроме того, как описано выше, доставка реагентов для редактирования генов in vivo может привести к нежелательным адаптивным иммунным реакциям против реагентов генотерапии (таким как нейтрализующие антитела или опосредованная Т-клетками токсичность трансдуцированных клеток), что может свести на нет любой терапевтический эффект44,46 (рис. 4). Примечательно, что эта проблема сохраняется даже для векторов на основе наночастиц. Например, на модели обезьян макак было показано, что использование редакторов оснований в печени не повышает эффективность редактирования генов при повторной дозировке, несмотря на их транзиторную доставку в виде мРНК с помощью липидных наночастиц, предположительно из-за развития антиген-специфических Т-клеток после первичной дозы и клиренса трансдуцированных клеток этими Т-клетками после второй дозы141. Эти исследования платформ генной инженерии на основе вирусов и наночастиц подчеркивают проблему, которую представляет собой адаптивная иммунная система для доставки реагентов для редактирования генов in vivo.
Более того, в то время как генотерапия ex vivo позволяет нацеливаться на HSCs , изолируя их от остального организма, доставка реагентов генной инженерии в HSCs in vivo создает риск нежелательной нецелевой трансдукции тканей. Такая нецелевая трансдукция может увеличить риск потенциальных осложнений, связанных с токсичностью врожденного иммунитета, и может привести к нежелательным генетическим модификациям внецелевых клеток, которые могут нанести вред здоровью пациента. Кроме того, было показано, что экспрессия генов вне мишени влияет на риск адаптивного иммунного ответа против реагентов генотерапии и трансгенов, поскольку различные ткани отличаются по своей воспалительной среде. Например, для успешной долгосрочной экспрессии трансгенов в печени с помощью лентивирусных векторов, введенных in vivo, потребовалось использование промоторов, специфичных для типа клеток, и микроРНК для ограничения экспрессии генов в тканях-мишенях142. Это было необходимо для предотвращения нежелательного адаптивного иммунного ответа против введенного трансгена и последующего уничтожения трансдуцированных клеток антиген-специфическими Т-клетками.
Conclusions
В настоящее время в области генотерапии HSCs наступило захватывающее время. Недавние клинические успехи подчеркнули преобразующий потенциал генотерапии HSCs в лечении заболеваний. По мере решения технических проблем, связанных с разработкой эффективных методов генотерапии HSCs , возникают новые проблемы, связанные с внедрением нового поколения методов генотерапии HSCs . Современная парадигма аутологичной генотерапии HSCs ex vivo очень персонализирована и чрезвычайно сложна с технической точки зрения, что делает генотерапию HSCs чрезвычайно дорогой. Примером может служить генотерапия betibeglogene autotem (торговое название Zynteglo) для лечения β-талассемии, которая, несмотря на получение клинического одобрения, была снята с европейских рынков из-за ее стоимости в 1,8 млн. долл. на пациента143. Однако для некоторых заболеваний высокая стоимость лечебной генной терапии HSCs может в конечном итоге оказаться меньше, чем общие затраты на хроническое использование традиционных методов лечения заболевания в течение всей жизни пациента. К сожалению, при некоторых из основных заболеваний, для которых разрабатывается генотерапия HSCs , таких как серповидно-клеточная болезнь и ВИЧ-1, большинство пациентов живут в странах с низким уровнем дохода и, скорее всего, не будут иметь доступа к этим методам лечения, пока не будут решены экономические вопросы, связанные с их внедрением. По мере того, как аутологичная генная терапия HSCs становится более упорядоченной и замкнутой, автоматизированные системы снижают ее технические сложности, а также стоимость, и мы надеемся, что эти экономические проблемы аутологичной генной терапии HSCs могут быть преодолены. В качестве альтернативы, разработка нового поколения масштабируемых готовых аллогенных или in vivo генных терапий HSCs может предложить альтернативные подходы к решению этих экономических проблем, если удастся решить иммунологические проблемы, связанные с их применением.
По мере развития генотерапии HSCs возникли проблемы как со стороны врожденного, так и адаптивного иммунитета. Эти проблемы должны быть преодолены, чтобы успешно и безопасно применять генотерапию HSCs нынешнего и следующего поколения. Мы считаем, что в ближайшем будущем прогресс генотерапии HSCs будет определяться нашей способностью решать эти иммунологические проблемы. Адаптивная иммунная система, в частности, представляет собой серьезную проблему для генотерапии HSCs следующего поколения, поскольку она может привести к отторжению неоантигенов, введенных в HSCs , реагентов генной инженерии, доставленных in vivo в HSCs или аллогенных готовых HSCs . Гемопоэтическая система уникальна тем, что лимфоаблация предлагает один из потенциальных путей решения большинства этих проблем; однако лимфоаблация имеет существенные недостатки с точки зрения здоровья пациента, поэтому следует искать и другие пути решения этих проблем. Некоторые потенциальные решения для толерантности иммунной системы к неоантигенам - это инженерия клеток, чтобы стать гипоиммунными, а также использование полученных из HSCs APCs для толерантности иммунной системы. Однако ни одна из этих стратегий не была проверена клинически, и необходимы дополнительные исследования для включения этих методов в генную терапию HSCs . Синтезируя эти иммунологические проблемы в данном обзоре, мы надеемся побудить больше иммунологов исследовать и решать иммунологические проблемы в текущих и следующих поколениях генной терапии HSCs , чтобы реализовать весь потенциал этого подхода для улучшения здоровья человека.