Посещений: 
РЕДАКТИРОВАНИЕ ГЕНОВ С ИСПОЛЬЗОВАНИЕМ НАНОЧАСТИЦ ЗОЛОТА
Успехи и проблемы
Gold Nanoparticle-Mediated Gene Therapy Gayathri A. Kanu,
Javad B. M. Parambath, Raed O. Abu Odeh and
Ahmed A. Mohamed
 Cancers 2022, 14(21), 5366; https://doi.org/10.3390/cancers14215366
|
Gold nanoparticles (AuNPs) have gained increasing attention as novel drug-delivery nanostructures for the treatment of cancers, infections, inflammations, and other diseases and disorders. They are versatile in design, synthesis, modification, and functionalization. This has many advantages in terms of gene editing and gene silencing, and their application in genetic illnesses. The development of several techniques such as CRISPR/Cas9, TALEN, and ZFNs has raised hopes for the treatment of genetic abnormalities, although more focused experimentation is still needed. AuNPs, however, have been much more effective in trending research on this subject. In this review, we highlight recently well-developed advancements that are relevant to cutting-edge gene therapies, namely gene editing and gene silencing in diseases caused by a single gene in humans by taking an edge of the unique properties of the AuNPs, which will be an important outlook for future research.
|
Неорганические функциональные наноматериалы появились как надежные и адаптируемые нано-каркасы для доставки генов [1,2]. Синтез многочисленных первичных белков в микробах и живых клетках находится в центре внимания передовых рекомбинантных технологий, которые пришли на смену устаревшим методам и современным тенденциям в био-нанотехнологиях. Например, проект "Геном человека" и его разработки в области молекулярной генетики с использованием высокопроизводительных методов позволили расшифровать генетический фон многочисленных заболеваний и обнаружить новые терапевтические мишени [3]. Больше внимания уделяется нано-медицине, которая обладает огромным будущим потенциалом для улучшения методов лечения на основе нуклеиновых кислот, таких как редактирование генов, подавление генов и вирусные векторы. Они способны значительно продвинуть лечение рака и генетических заболеваний, таких как острый иммунодефицит и паркинсонизм [4].
В принципе, генотерапия основана на доставке рекомбинантных синтезированных нуклеиновых кислот для вставки, удаления, редактирования или глушения гена или последовательностей генов, в отличие от лекарств, которые вызывают более впечатляющие фенотипы. В результате можно восстановить функцию клеток при моногенных заболеваниях или придать клеткам новые способности. Однако для достижения этой цели необходимо преодолеть множество препятствий, в частности, неспецифический захват средств доставки генов ретикулоэндотелиальной системой печени и эндосомной ловушкой, что приводит к заметному снижению эффективности доставки в ткани/клетки-мишени [5]. Олигонуклеотиды (например, анти-смысловые олигонуклеотиды) и поли-нуклеотиды (например, мРНК) имеют относительно ограниченный период полураспада в физиологических жидкостях из-за присутствия эндо- и экзонуклеаз [6,7], и это является основной проблемой для обеспечения их доставки в органы/ткани/клетки-мишени без деградации.
Создание безопасных, биосовместимых нано-носителей, которые могут конъюгировать с генетическими материалами для переноса терапевтических агентов в различные клетки, ткани или органы, является наиболее сложной инженерной задачей, возникающей при создании эффективной системы доставки [8]. Хотя нано-носители на основе вирусов высокоэффективны и широко используются в иммунизации, исследователи неустанно стараются избегать использования вирусов из-за присущей им иммуногенности, сложных синтетических путей и предварительной модификации белков [8]. Синтетические методы с минимальной или низкой иммуногенностью, высокой биосовместимостью, простотой изготовления, программируемой целевой способностью и возможностью многократного введения [9-11] рассматриваются как перспективные альтернативы.
Наночастицы золота (AuNPs) подробно анализировались в течение десятилетий и являются наиболее разработанной альтернативой для ряда медицинских приложений, таких как зондирование, визуализация, катализ, терапия, диагностика, лекарства и доставка генов [12,13]. AuNPs обладают уникальными свойствами, которые отличают их от альтернатив [14]. Во-первых, благодаря своим физико-химическим свойствам AuNP могут быть покрыты катионными молекулами для изменения поверхностного заряда наноструктур и усиления связывания ДНК посредством электростатического взаимодействия. Подтверждающие исследования продемонстрировали эффективность AuNPs как носителей ДНК [15,16]. Во-вторых, превосходные фотофизические свойства AuNPs имеют решающее значение для биодиагностики. В-третьих, простая химия поверхности позволяет им функционировать как синтетические антитела со связывающими взаимодействиями, которые можно точно регулировать, изменяя плотность связывающих молекул в их оболочке.
2. Gene Editing
2.1. CRISPR/Cas9 System
Генетические заболевания, которые ранее считались неизлечимыми, вскоре могут быть вылечены благодаря простоте использования, универсальности, точности и специфичности системы "CRISPR-Cas9". Открытие кластеризованных регулярно перемежающихся коротких палиндромных повторов, системы CRISPR-ассоциированной нуклеазы (CRISPR/Cas9) и переход геномной инженерии от бактериальных клеток к клеткам млекопитающих ознаменовали собой существенные изменения. Этот метод геномной инженерии был использован не только в различных клеточных линиях, но и в первичных и стволовых клетках человека. Более того, в экспериментах in vivo использовались рыбки данио и мыши для исследования функций генов, моделей рака и методов генотерапии [17-23]. Таким образом, метод CRISPR/Cas9 способен изменить способы лечения генетических заболеваний [24,25]. В последнее время для лечения наиболее распространенных генетических заболеваний, таких как рак, используются генетические подходы на основе CRISPR/Cas9. Однако в списке есть еще несколько заболеваний, таких как мышечная дистрофия Дюшенна, муковисцидоз, врожденный амавроз Лебера, талассемия, серповидно-клеточная болезнь и болезнь Хантингтона, которые могут лечиться или вылечены с помощью аналогичных генетических подходов [26,27].
В хорошо разработанной системе CRISPR-Cas9 есть два основных компонента: первый - single-guide RNA (sgRNA), второй - эндонуклеаза Cas9. При необходимости система также может включать донорский шаблон для гомологичной репарации. Вместе эти два элемента создают активные рибонуклеопротеиновые (RNP) комплексы, которые могут точно определить геномный регион, где в результате редактирования образуются двунитевые разрывы (DSB) [28-30]. Прикладная система адресной доставки, специфичная для заболевания, особенно техника CRISPR-Cas9, требует эффективного метода переноса или молекулы для достаточного поглощения клетками и защиты от деградации белка, что в конечном итоге приводит к эффектам on-/off-target при конкретном заболевании [31]. Химические методы или синтетические трансфекционные носители имеют то преимущество, что их свойства могут быть приспособлены для удовлетворения потребностей доставки CRISPR-систем при коррекции генов. Кроме того, они помогают преодолеть ограничения по биобезопасности, загрузке и возможности упаковки. Невирусные векторы, по сравнению с вирусными, обладают низкой иммуногенностью, отсутствием эндогенной вирусной рекомбинации, снижают ограничения в доставке больших генетических нагрузок и более просты в крупномасштабном производстве. Невирусные векторы могут предложить заманчивые перспективы для доставки CRISPR-Cas9. Именно поэтому невирусные векторы рассматриваются в качестве альтернативы для трансляционных исследований CRISPR-Cas9 генотерапии [32-34]. Схематическое изображение системы доставки на основе CRISPR-Cas9 показано на рисунке 1.
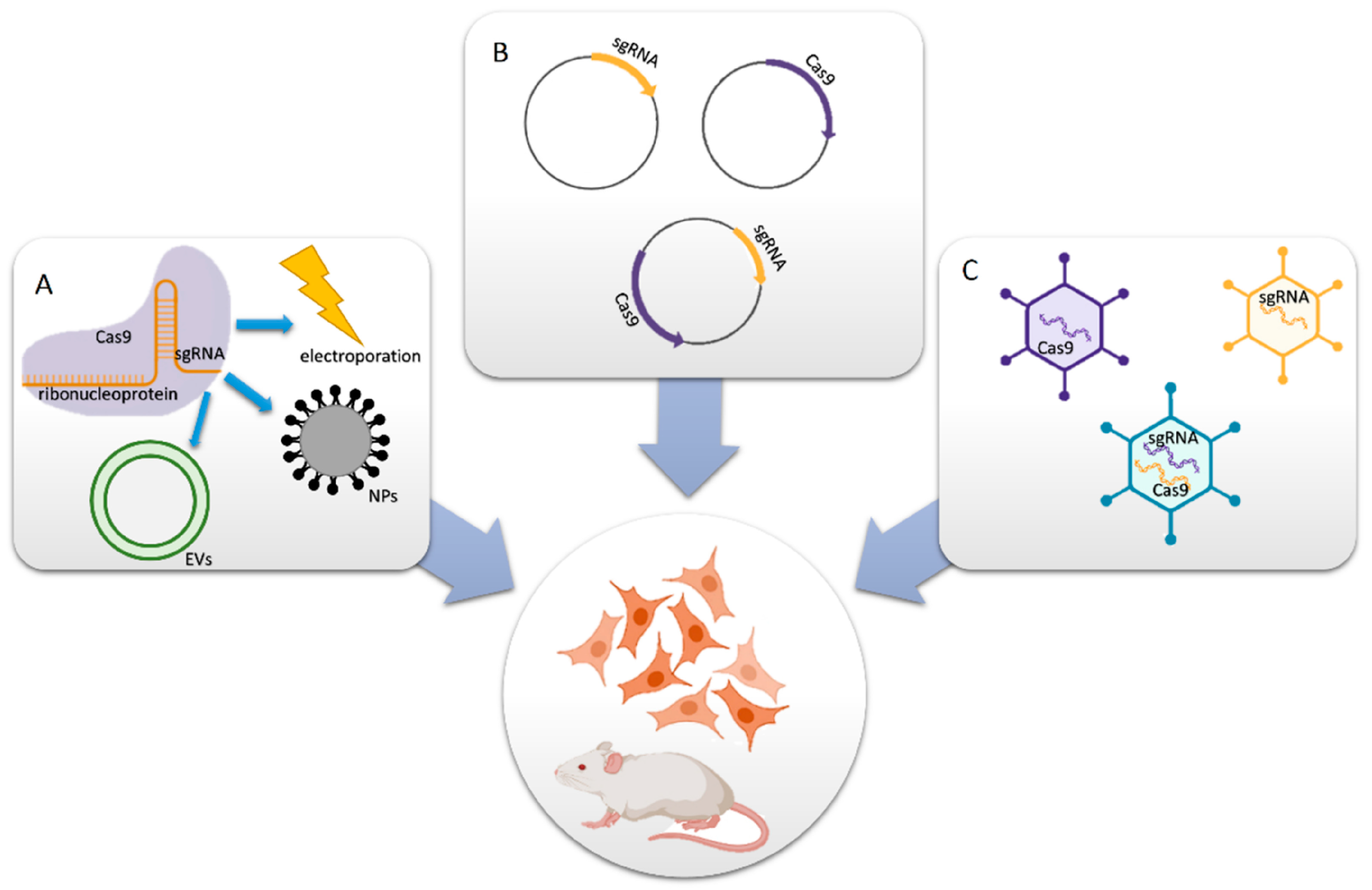 Figure 1. Delivery methods for CRISPR-Cas9 components.
(A) Cas9 protein and sgRNA form an RNP complex for packaging purposes. (B) Cas9- and/or sgRNA-expressing plasmids are transferred into cells. (C) In vitro or in vivo viral vectors encoding Cas9 and/or sgRNA convey the mechanisms (reprinted with permission from [34]). Самый короткий метод совместной доставки Cas9 белка и sgRNA был разработан Mout et al., впервые представившие использование материалов на базе AuNPs для редактирования генома (Figure 2A [35]). Предлагаемый белок Cas9 был использован для взаимодействия с катионами arginine-AuNPs, sgRNA, и негативно заряженной меткой пептида glutamate. AuNPs и доставляемая полезная нагрузка взаимодействовали, чтобы создать нано-ансамбли, которые могут быстро соединяться с клеточными мембранами и высвобождать сжатый белок Cas9 и sgRNA груз в цитоплазму. До 90% генов мишеней были успешно трансфицированы с использованием этого метода, при этом наблюдалась высокая эффективность редактирования гена такая же как при adeno-associated virus integration site 1 (AAVS1) (29%) и phosphatase and tensin homolog (PTEN) (up to 30%) in in vitro исследованиях.
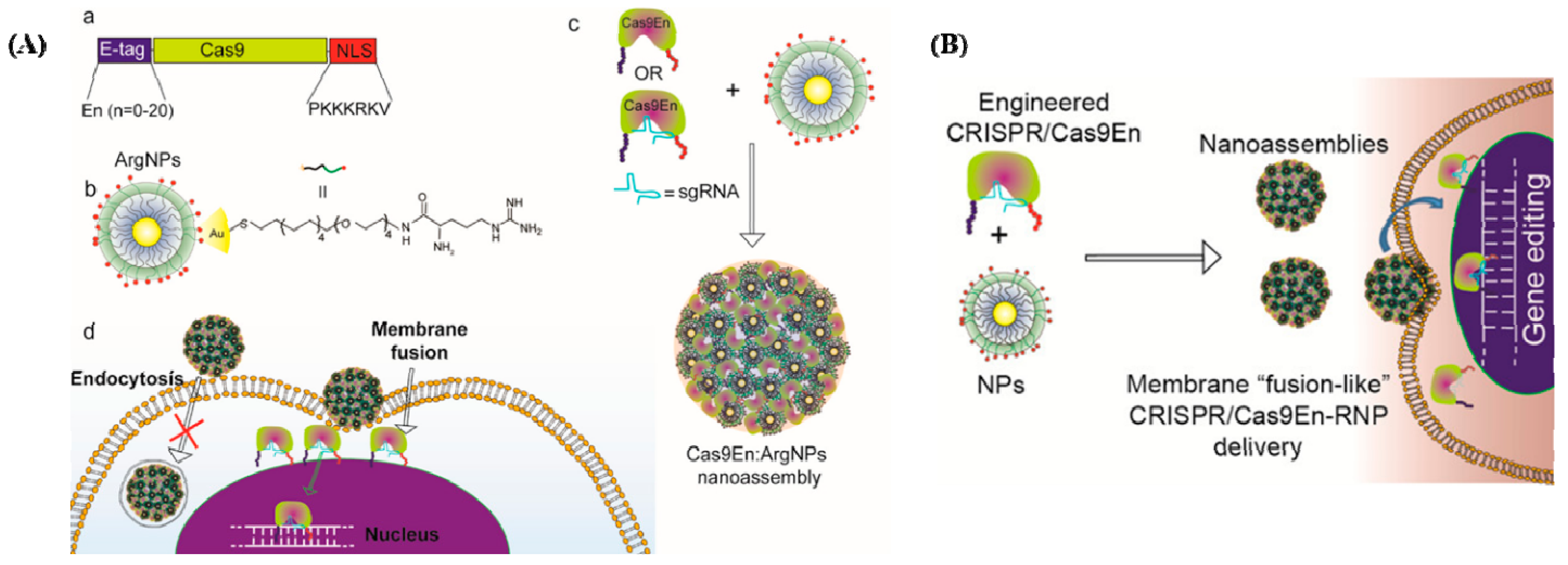 Figure 2. (A) Cas9/sgRNA delivery using AuNPs and gene editing. (a) Cas9 protein engineered with ArgNPs for intracellular delivery of Cas9-protein/RNP through membrane fusion. Illustration of Cas9 transporting an E-tag at the N-terminus and a nuclear localization signal at the C-terminus (NLS). (b) Chemical structure of ArgNPs. (c) Nano assembly of Cas9En-RNP and ArgNPs. (d) A membrane fusion method for delivering Cas9En (reprinted with permission from [35]). (B) Conjugation of Cas9 nuclease and carrier NPs makes CRISPR component packing and transport more efficient. Cas9En self-assembled into massive nano assemblies with arginine-functionalized-AuNPs (reprinted with permission from [35]).
Lee et al. разработали CRISPR-AuNPs транспортное средство для прямой передачи и быстрого выделения рибонуклеопротеина Cas9 и шаблонов репарации для донорской ДНК для исправления изменений генов в модели для изучения мышечной дистрофии Дюшенна (MDX) мышей [36]. AuNPs размером 15 нм сначала конъюгировали с тиол-модифицированными олигонуклеотидами, затем скрещивали с донорской ДНК и загружали комплексом Cas9-RNP, и, наконец, покрывали катионным полимером, poly{N-[N'-(2-aminoethyl)-2-aminoethyl] aspartamide}, PAsp (DET). PAsp (DET) на внешней стороне CRISPR-AuNPs может вызвать растягивание эндосомы и обеспечить выход эндосомы в конце клеточного эндоцитоза, высвобождая ее в цитоплазму и вызывая высвобождение комплекса Cas9-RNP и донорной ДНК из CRISPR-AuNPs. Внешнее покрытие PAsp (DET) облегчает эндосомный выход. Повышение внутриклеточного уровня (~10 мМ) глутатиона позволяет высвободить комплекс Cas9-RNP и донорскую ДНК из CRISPR-AuNPs. Это позволило восстановить функциональную последовательность дикого типа у MDX дистрофин-дефицитных мышей, что уменьшило мышечный фиброз, восстановило экспрессию белка дистрофина и восстановило мышечную функцию без полного повреждения воспалительных цитокинов. CRISPR-AuNPs, используемые вместе, представляют собой возможный метод активного лечения пациентов с DMD путем устранения мутантных генов.
Типичная одиночного гена форма расстройства аутистического спектра была использована в мышиной модели синдрома Fragile X. Ли и др. использовали CRISPR-AuNPs в качестве носителя для переноса RNP в мозг и помогли мыши восстановить поведение высокой повторяемости [37]. После внутричерепной инъекции CRISPR-AuNPs, нацеленных на ген mGluR5 в стриатуме мышей дикого типа или нокаутных мышей Fmr1, локальные уровни гена mGluR5 в стриатуме были успешно снижены.
AuNPs были изучены в сочетании с их фототермическими свойствами и традиционными преимуществами частиц на основе липидов [38], при этом катионные AuNPs были сформированы путем присоединения коротких пептидов. Это соединение ускоряет клеточное поглощение ТАТ-пептидами AuNPs. Затем с катионными AuNPs была соединена плазмида Cas9-sgRNA, нацеленная на polo-like kinase 1 (PLK-1). Затем на AuNP-плазмиду была нанесена смесь катионных липидов, состоящая из 1,2-диолеоил-3-триметиламмониумпропана, диолеоилфосфатидилэтаноламина DOPE и холестерина, и частицы были усилены добавлением 1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин-поли(этиленгликоля) и 2-дистеароил-sn-глицеро-3-фосфоэтаноламин-поли(этиленгликоля) для повышения устойчивости. Было подтверждено, что разрушение PLK-1 в клетках меланомы было усилено облученными светом AuNPs.
Гибкая катионная платформа AuNP, известная как аргинин ArgNPs, была разработана для улучшения переноса через мембрану [35,39]. Инженеры использовали Cas9 с глутаматной пептидной меткой и NLS, поскольку глутаминовая кислота создает отрицательный потенциал вокруг Cas9 RNP для соединения с положительными ArgNP. В отличие от эндоцитоза, было обнаружено, что Cas9-ArgNPs интернализируются клетками через мембран-подобную процедуру, требующую холестерина. Более того, доставка в цитозоль была связана с длиной цепью используемого глутаматного пептида. В клетках HeLa Cas9-ArgNPs, нацеленные на гены PTEN или AAVS1, вызывали 30% indels, демонстрируя редактирование генов. Другое исследование показало гибкость этого метода доставки, используя Cas9-ArgNPs для получения SIRP-нокаутных макрофагов RAW264. 7 для усиления фагоцитоза раковых клеток [40].
SpCas9-AuNCs были локализованы в клетках посредством эндоцитоза и подвергнуты действию эндосомного и лизосомного низкого pH, что вызвало диссоциацию SpCas9-AuNCs, а также действию протонной губки, что впоследствии привело к высвобождению SpCas9 в цитоплазму [41]. Затем SpCas9-AuNCs были использованы для проверки возможности редактирования гена E6 в геноме HPV 18 в клетках HeLa с помощью трансфекции E6 sgRNA, и после обработки SpCas9-AuNCs экспрессия белка E6 HPV18 резко снизилась.
Mout и др. сконструировали белок Cas9 так, чтобы он имел отрицательный заряд, в результате чего получился белок, напоминающий sgRNA электростатически [35]. В данном исследовании олиго-тег глутаминовой кислоты (E-tag) был слит с N-концом белка Cas9, Cas9En (n: глутаминовые кислоты), а sgRNA были собраны с катионными аргининовыми AuNPs (ArgNPs) и доставлены непосредственно в цитоплазму и ядро (Рисунок 2B).
2.2. Zinc Finger Nucleases (ZFNs) and TALENs Gene Editing
ZFNs были впервые обнаружены в ооцитах Xenopus как компонент транскрипционного фактора IIIa [42], и впоследствии они были идентифицированы как сайт-специфическая эндонуклеаза для разрезания ДНК [43]. ZFNs обладают сайт-специфическими свойствами связывания ДНК. Они обладают группой цинковых пальчиков (ZF) Cys2His2, образованных в результате взаимодействия между их ZF-доменами и аналогичными участками ДНК. ZF-белки представляют собой тип транскрипционного фактора, соединенного с эндонуклеазой. Каждая ZF-единица специфически идентифицирует три пары оснований ДНК и создает специфические для основания связи, взаимодействуя с основной бороздкой ДНК [44,45] через свои спиральные остатки.
Они могут связываться с любым триплетом в его естественных условиях, которые варьируются в зависимости от состояния ткани, контекста белка и последовательности ДНК. Одиночные цинковые пальчики, которые имеют аминокислоты [46,47], представляют собой прямолинейные структуры с необычайно высокой степенью функциональной гибкости и структурной податливости. Эффективность HR значительно повысилась благодаря внедрению ZFNs для создания ген-специфических разрывов ДНК [48]. RE типа II FokI создает домен расщепления ДНК, а затем димеризуется для специфического воздействия на соответствующие участки [49]. Активными являются два экзогенных белковых домена: первый - нуклеаза рестрикции FokI, а второй - сивенс-специфический zinc-finger transcription factor protein (ZFP). FokI, фермент нуклеазы рестрикции, обнаруживает тринуклеотидные последовательности ДНК, ZFP обнаруживает сиквенс-специфичные последовательности и FokI. Нуклеазный домен, состоящий из широкого набора цинковых пальчиков C2H2, взаимодействует с этим доменом, ограничивая ДНК-связывающую специфичность ZFNs и направляя их к сайту-мишени (рис. 3A). Процесс восстановления генов с помощью ZFN выглядит следующим образом: идентификация полного сайта связывания ZFN в целевом GOI (интересующем гене); конструирование пары ZFN; тестирование пары ZFN на активность; определение конструкции нацеливания для получения ожидаемых геномных модификаций; совместная передача ZFNs и вектора нацеливания для получения разрезов и вставки терапевтического трансгена в GOI [50]. На рисунке 3B-a клеточное таргетное вещество и полезная нагрузка в виде цитотоксического белка, соответственно, были генетически соединены с двумя формами ZnF, которые распознают различные последовательности ДНК. С помощью химии стрептавидин-биотин была создана двухцепочечная ДНК с большим количеством сайтов связывания ZnF, которая была присоединена к золотым наночастицам. Для создания сборки нуклеопротеиновых наночастиц белки, слитые с ZnF, и наночастицы, и функционализированные ДНК, были совместно инкубированы.
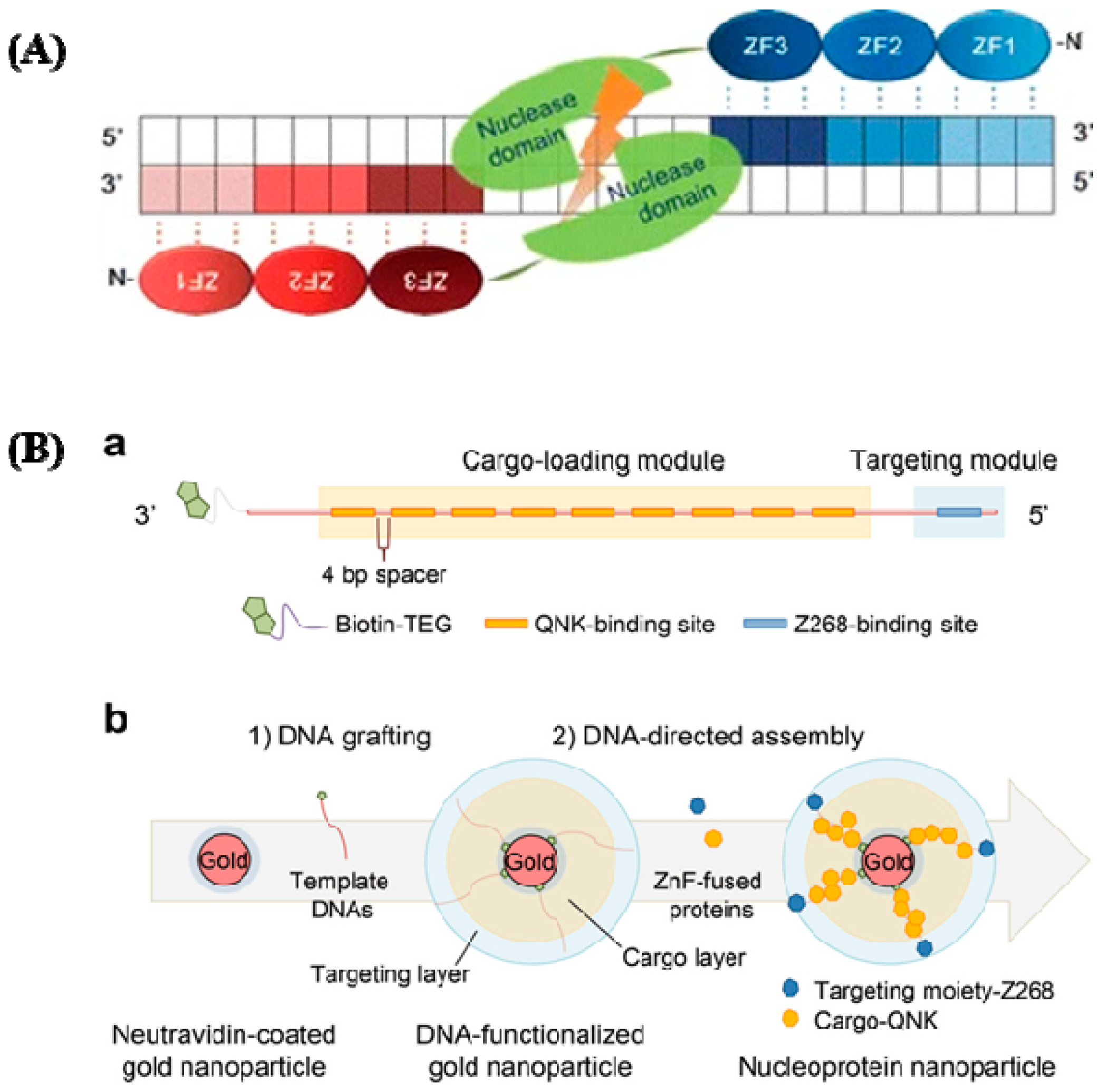 Figure 3. (A) ZFNs have a specific structure. ZFNs linked to their target locations are depicted schematically. This is a well-designed ZF DNA domain fused to the FokI type IIS restriction enzyme's DNA cleavage domain that forms nucleases. Each ZFN protein has three ZFs (shaded ovals) that recognize a target sequence in the DNA (shaded boxes). The binding of two ZFNs on target DNA with a spacer (5/6 bp) in the center causes the ZFN nuclease domains to dimerize and the target DNA to be cleaved (reprinted with permission from [51]). (B) DNA and zinc fingers are used to program the construction of nucleoprotein nanoparticles. (a) Template modular DNA design. A biotin molecule was added at the 3' end of the template DNA with a TEG linker for grafting template DNA onto AuNPs. To eliminate steric hindrance, multiple binding sites for QNK-QNK-RHR (QNK) were spatially organized with a four-base-pair spacer. (b) Sequential construction of nucleoprotein nanoparticles is depicted schematically (NNPs) (reprinted with permission from [52]).
ZFP встречаются в значительных количествах в геномах различных организмов; у человека они составляют 3% всего генома и являются очень распространенными ДНК-связывающими мотивами в транскрипционных факторах. Благодаря значительным достижениям последнего времени [51,52], постепенно раскрывается роль ZFPs в здравоохранении. Они становятся признанными мишенями для лечения рака [53,54], вирусных инфекций [55] и, в последнее время, неврологических расстройств. Fairall и др. заметили, что соединения металлов вытесняют Zn (II) из ZFPs [45]. Благодаря лучшему пониманию того, как комплексы металлов взаимодействуют с ZFs, были созданы инновационные металлические соединения для воздействия на конкретные ZFs с помощью координационной и металлоорганической химии. Для точной модуляции внутриклеточных сигнальных путей все большее внимание привлекают различные методы доставки белков [56-66]. Металлические NPs являются исходными специальными материалами для создания нано-носителя благодаря своим отличительным нано размерам и морфологии. Нуклеопротеиновые слоистые AuNPs с использованием ДНК и ZnFs были исследованы для целевой доставки белка в ксено-трансплантационных моделях мышей [67], и это показало их полезность и потенциал, продемонстрировав компетентный и селективный для опухоли цитозольный транспорт белкового груза, а также значительную регрессию опухоли при незначительной токсичности (рис. 3B). Другая группа исследовала кластеры наночастиц как улучшенный контрастный агент для MRI и двойной зонд для магнитной и флуоресцентной визуализации, используя клетки HeLa для изучения избыточной экспрессии фолатных рецепторов [68].
Как и ZFNs, TALENs являются белковыми нуклеазами природного происхождения, которые вызывают DSBs ДНК путем слияния неспецифического домена расщепления ДНК с последовательно-специфическим ДНК-связывающим доменом. Высоко консервативная повторяющаяся последовательность из транскрипционного активатора-подобного эффектора (TALE), белка, первоначально обнаруженного у фитопатогенных бактерий Xanthomonas, который спонтанно изменяет транскрипцию генов в клетках растений-хозяев, составляет эту "ДНК-связывающую область" [69,70]. ZFNs и TALENs структурно и функционально идентичны, причем TALENs более специфичны, хотя оба содержат эндонуклеазу рестрикции Fok [69]. Для связывания с определенной последовательностью ДНК эффекторные белки TAL должны быть сконструированы. TALE связывается с ДНК посредством участка ядра, содержащим набор трехаминокислотных (33-35) мотивов (рис. 4). Типичный ДНК-связывающий домен TALE распознает 1420 нуклеотидов, включая консервативное основание тимин (T) на границе 5' . Repeat-variable di-residues RVDs) [70,71] - это две чрезвычайно вариабельные аминокислоты, которые определяют ибирательность TALE. RVDs консервативны в положениях 12 и 13 [72]. Известно около 24 различных RVD, и эти петли RVD содержат аминокислотный повтор с отсутствующим остатком, обозначаемый символами N*, причем наиболее распространенным является 33 [73]. Собрать четыре базовых компонента, способных распознавать основания A, T, G и C, в TALEN легче, чем собрать субъединицы ZFN, распознающие 64 различные пары триолов или триплетов ДНК. ZFNs и TALENs, с другой стороны, полагаются на высокоточные взаимодействия белка с ДНК, которые допускают меньшее количество несоответствий [74].
 Figure 4. A TALEN dimer coupled with target DNA is shown schematically. To develop a modified nuclease that can detect unique left and right half-sites, TALE arrays are fused to the FokI nuclease domain. A spacer 12-20 bp in length separates the two TALE binding sites (reprinted with permission from [74]).
Вставляя NHEJ/HDR-индуцированное изменение в кодирующую область, TALEN смогли разрушить гены NTF3 и CCR5 в клетках лейкемии человека, это указывает на то, что TALEN предназначены для расщепления эндогенных генов [75]. Разрушение одного аллеля гена Fms-related tyrosine kinase 3 (FLT3) с помощью сайт-специфического TALEN привело к созданию изогенных клонов лейкозных клеток. Использование искусственных TALEN в клетках рака простаты и реорганизация генов-мишеней андрогенового рецептора (AR) являются функционально категоризированными источниками резистентности [75]. Кроме того, исследования показали, что данный вид технологии редактирования генов является мощной и широко подходящей платформой для изучения трансмутаций генов на молекулярной основе. Эта технология была использована в раковых клетках, таких как клетки рака простаты, клетки рака молочной железы [76] и клетки гепатоцеллюлярной карциномы (ГЦК) [77] для нокаута генов. Однако из-за многочисленных ограничений ZFN и TALEN, исследования по применению в нано-медицине были ограничены или отсутствовали.
3. Gene Silencing
3.1. RNA Interference (RNAi)
Новаторское исследование, проведенное на нематоде Caenorhabditis elegans, показало, что RNAs являются эволюционно консервативным механизмом замалчивания генов [78,79]. RNA Interference (RNAi) - это клеточный механизм, который нацелен на мРНК и подавляет трансляцию, чтобы заставить замолчать специфические гены [80]. В этом механизме антисмысловая область ds-RNA направляет распознавание и каталитическую деградацию мРНК-мишени комплексом РНК-индуцированного сайленсинга. Анти-смысловая нить дуплекса двухцепочечной РНК является посредником одного из типов siRNA (короткой интерферирующей РНК), которая направляет распознавание и каталитическую деградацию мРНК-мишени с помощью RNA-induced silencing complex's (RISC). Двухцепочечные последовательности РНК, называемые siRNA, интегрируются в RISC [81-85]. Направляющая (анти-смысловая) нить и пассажирская (смысловая) нить составляют собой 21-нуклеотидный дуплекс siRNA. Argonaute2 (Ago2) - это эндонуклеаза, которая удаляет направляющую/пассажирскую нить. Другой процесс осуществляется эндогенными в 20-25 нт короткими РНК, называемыми микроРНК (миРНК), которые либо способствуют, либо подавляют трансформацию своих мРНК-мишеней [85]. Перспективным методом секвенс-специфического подавления генов является генотерапия RNAi, которая может лечить серьезные заболевания человека, такие как генетические нарушения, вирусные инфекции и рак [86-89]. Существует большой интерес к этой технологии и к углублению наших знаний об основных принципах обоих путей, чтобы использовать их в медицинских целях, поскольку доставка малых РНК в клетки для регуляции экспрессии генов была затруднена [90]. Прохождение этих РНК через клеточную мембрану затруднено из-за их отрицательного заряда и молекулярной массы около 13 кДа. Кроме того, в присутствии РНКазы в сыворотке крови siRNA более чувствительна к разрушению, что требует использования молекулы-носителя для достижения цели. siRNA может комплексоваться или конъюгироваться с различными транспортерами, и наше понимание того, как доставляется siRNA, продвинулось вперед [91].
Благодаря своему терапевтическому потенциалу, AuNPs нашли применение во многих аспектах нано-медицины, и они являются одной из самых передовых платформ для доставки генов [92,93]. AuNPs могут быть загружены и объединены с отрицательно заряженными генными препаратами [94], при условии, что сердцевина покрыта послойной оболочкой из биоразлагаемых полимеров. С помощью различных поверхностно-активных веществ AuNPs часто получают в водных растворах, где они затем адсорбируются или осаждаются на поверхности [95].
В исследовании катионных фосфолипидных покрытых золотых нано-стержней в качестве систем распределения полезной нагрузки нуклеиновых кислот, когда отрицательно заряженные олигонуклеотиды ДНК, РНК или siRNA были прикреплены к положительно заряженной фосфолипидной поверхности, интернализация AuNRs наблюдалась с помощью микроскопии рассеяния темного поля [96]. Conde и др., начиная с культивируемых клеток человека, а затем используя беспозвоночные и позвоночные (мыши) модели, использовали композиции AuNP для эффективной доставки RNAi. Это привело к молчанию протоонкогена c-myc [97]. Основная идея этой комбинации заключается в ковалентном присоединении нуклеиновых кислот к AuNPs, что не нарушало их биологической активности [98]. Graczyk и др. показали, что ген CopGFP, экспрессируемый в модельной клеточной линии и являющийся мишенью нового тримера (AuNPs, связанные со структурными нано-частицами РНК (tectoRNAs) и несущие регуляторные фрагменты siRNA), может эффективно регулироваться тримером нового поколения, а также комплексом тример-AuNPs, нацеленным на три выбранных участка мРНК. Их конструкции tectoRNA-AuNPs обладают низкой цитотоксичностью в раковых и нераковых типах клеток, что указывает на их биосовместимость и возможность разгрузки в цитоплазме, как видно на изображениях трансмиссионной электронной микроскопии [99].
Показав, что анти-eGFP siRNA, pEGFP-N1 или pDsRed-Max-N1 могут быть упакованы для совместной доставки на AuNPs с помощью процедуры послойной самосборки, Bishop и др. изучили способность AuNPs доставлять нуклеиновые кислоты [96,100,101]. Были изготовлены конъюгаты многовалентного дезоксирибозима "10-23" AuNPs (DzNP) с различной плотностью ДНК, длиной линкера, ориентацией фермента и составом линкера для изучения влияния каталитического эффекта стерической среды и химии поверхности золота. Они продемонстрировали, что DzNP могут ингибировать экспрессию GDF15 в клетках через каталитический механизм, отличный от РНК-интерференции. Двойная техника DzNP и siRNA-AuNP имеет потенциал, поскольку действие DNAzyme дополняет регуляцию генов на основе siRNA, особенно для тех, кто намерен сосредоточиться на генах, влияющих на функцию RISC [100]. С другой стороны, сайленсинг генов исследовался с помощью многослойных siRNA-AuNPs путем измерения активности люциферазы в клетках MDA-MB231-luc2 (sRAuNPs). Это может быть связано с замедленным разрушением полипептида, поли-лизина (PLL), это означает, что интегрированное высвобождение siRNA имеет более длительный эффект замалчивания генов [101].
Снижая количество связанных белков и мРНК, Liu и др. исследовали, может ли использование золотых нано-потоков (GNFs) и siRNA (пул GNF-siRNA) предоставить in vitro и in vivo терапевтические преимущества при фототермическом лечении и глушении генов. Эти последовательности были использованы для подавления генов BAG3 и снижения системной токсичности. Более того, они экспериментально доказали, что "GNFs-siRNA" может способствовать клеточной интернализации и вызывать эндосомальный/лизосомальный выход siRNA, что приводит к подавлению белков и мРНК и указывает на то, что это подходящий вектор для переноса siRNA для реального PTT лечения [102] (рис. 5).
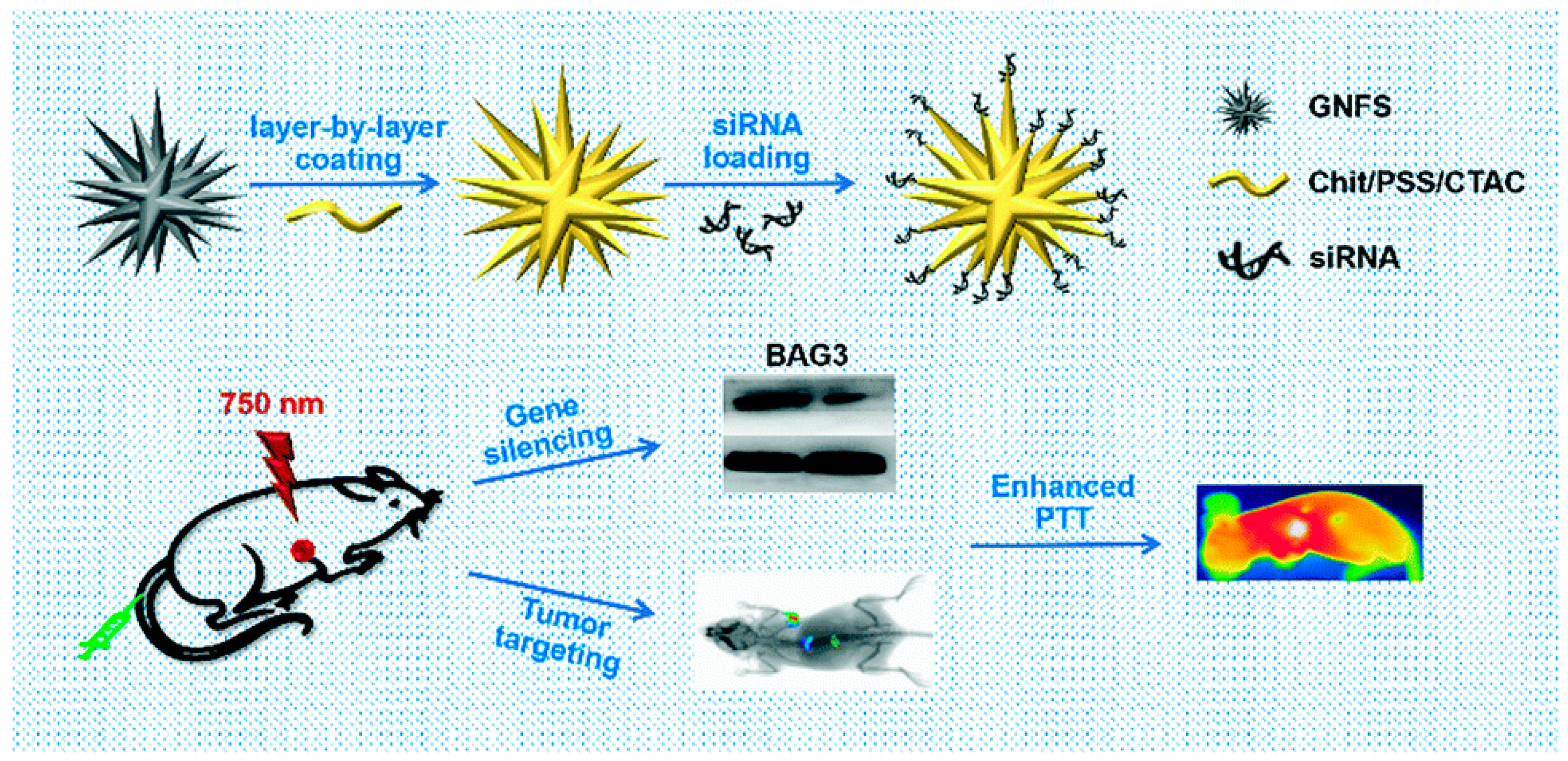 Figure 5. A schematic representation showing the preparation of "GNFs-siRNA" and the treatment process (reprinted with permission from [102]).
Shim et al. синтезировали агрегаты из siRNA, связанных с многочисленными AuNPs, используя чувствительную к кислотам ketal линкерную группу. AuNPs и олигонуклеотиды высвобождались, когда ketal линкер разрывался при низком pH. Целенаправленное замалчивание генов было продемонстрировано с помощью in vitro микроскопии на клетках, экспрессирующих GFP в условиях низкого уровня pH [103].
Chitosan (CS) и покрытые siRNA AuNPs (siRNA/CS-AuNPs) были синтезированы с использованием уникального подхода послойной самосборки. siRNA была защищена от ферментативной деградации в результате послойной самосборки siRNA/CS-AuNPs, сохраняя активность siRNA [102]. Чтобы объединить оптическую визуализацию с генотерапией, Shim и др. конъюгировали крошечные AuNPs с поверхностью полиплексов, несущих siRNA, с помощью кислотно-деградируемых соединений. Этот уникальный агностический препарат изменяет свои фотофизические свойства при наличии специфического для рака стимула. Одновременное изменение электромагнитного сигнала и глушение генов in vitro при специфических условиях, имитирующих рН опухоли, это используется для достижения комплексной диагностики и терапии рака (тераностика). Этот инновационный тип стимул-реактивной нанотераностики представляет собой инновацию для визуализации и лечения рака, которое является целевым, мультимодальным и комбинированным [103] (рис. 6).
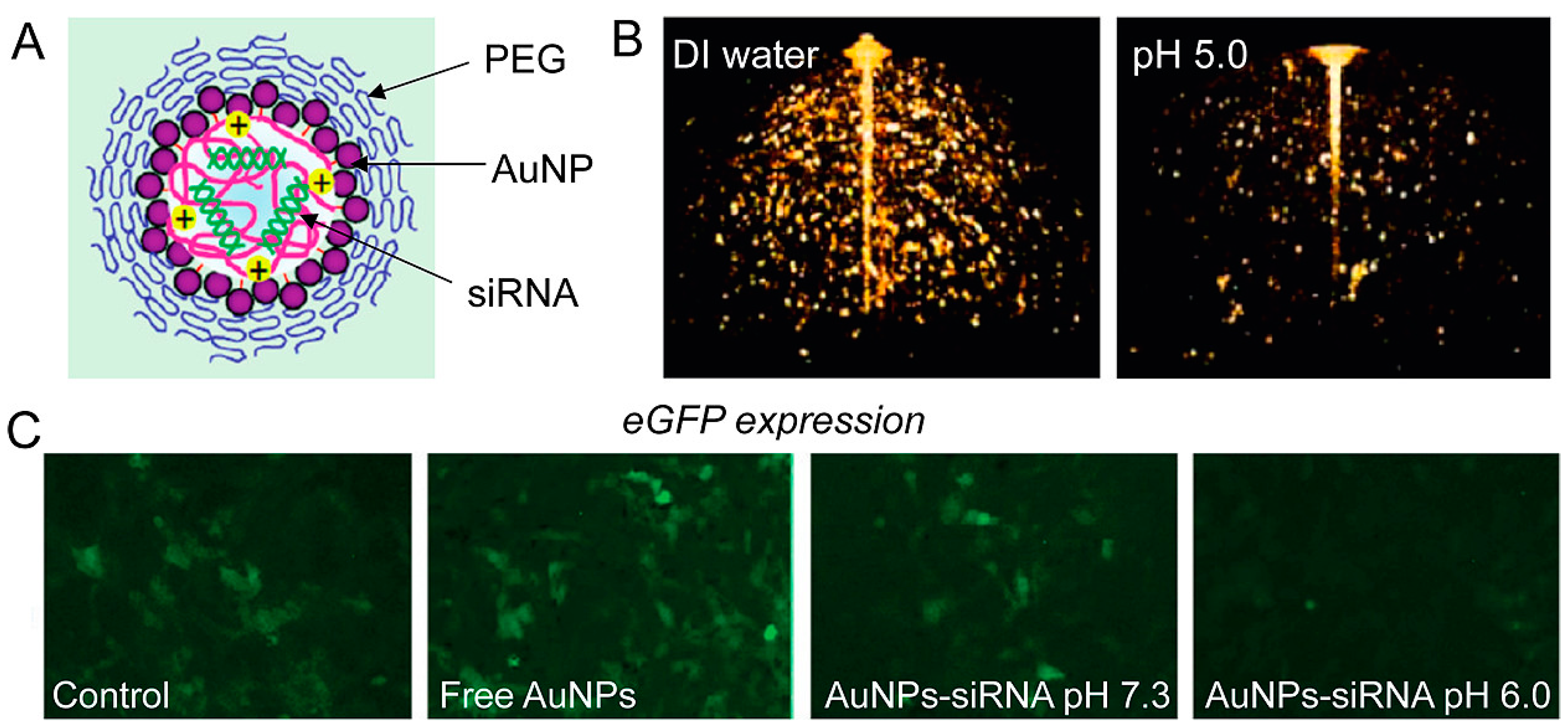 Figure 6. (A) AuNPs in imaging and gene-silencing NP design. The siRNA payload is released when the nanoparticle is hydrolyzed at a low pH. (B) Three-dimensional optical coherence tomography pictures of AuNP-based nanoparticles (the lower intensity image on the right confirms NPs' disintegration at lower pH). (C) When eGFP-expressing NIH 3T3 cells are treated with AuNPs-siRNA at low pH, fluorescence microscopy demonstrates gene silencing (reprinted with permission from [103]). 3.2. Antisense Oligonucleotides (ASOs)
Впервые они были обнаружены в работе Stephenson и Zamecnik где 13-мерные генерируемые ssASOs нацеливались на мРНК вируса саркомы Роуса [104-107], приводя к блоку трансляции [107]. Согласно нескольким исследованиям, активные ASOs обычно имеют длину 15-20 нуклеотидов и обладают исключительной специфичностью и сродством практически к любой комплементарной последовательности РНК, будь то пре-мРНК, мРНК, рибонуклеарные белки или миРНК, и что они подавляют гены мишени [105] путем базового сопряжения оснований без значительного увеличения far-off (отдаленной) токсичности [106]. Дальнейшие исследования показали, что два процесса, которые приводят к синтезу ASO, работают следующим образом: либо (1) повреждая РНК, либо (2) препятствуя трансляции РНК.
Ожидается, что анти-смысловые препараты будут успешны в лечении целого ряда заболеваний, включая рак и ВИЧ/СПИД [107]. FDA одобрило ASOs для лечения одиннадцати генетических заболеваний, и многие другие находятся в разработке. ASOs были одобрены департаментами здравоохранения многих стран, такими как Европейское агентство по лекарственным средствам (EMA) и FDA в США, и большинство из них получили коммерческое одобрение [107-109]. ASOs с трудом превращаются в эффективные терапевтические системы из-за проблем, связанных с устойчивой трансфекцией, доступом к различным видам клеток, токсичностью и эффективностью [110]. Для доставки нуклеиновых кислот в клетки были созданы различные невирусные агенты, такие как катионные липиды и полимеры, модифицированные вирусы, дендримеры, липосомы и наночастицы [111-113], но каждый подход имеет свой набор ограничений. ASOs также должны обладать благоприятными безопасными, фармакокинетическими и фармакодинамическими профилями, а также устойчивостью к нуклеазам [114]. Анти-смысловой олигонуклеотид когда защищен от разрушения РНКазой с помощью AuNPs, то это увеличивает период полураспада и, как следствие, груз лечебных агентов, поступающих в клетки. Для различных молекул нуклеиновых кислот, включая анти-смысловую одноцепочечную ДНК, способность AuNPs векторизовать исполнительные механизмы для подавления генов путем простой сборки на сердцевине наночастицы была установлена i n vitro и in vivo [114-118]. PBP2A является селективным антимикробным препаратом, который восстанавливает восприимчивость, вызывая вирулентность путем экспрессии пенициллин-связывающего белка 2a (PBP2a), который считается транспептидазой, кодируемой геном mecA [119]. Как показано на рисунке 7, Beha и др. представили многослойно покрытые AuNPs (ML-AuNPs) для доставки ASO, нацеленных на ген резистентности метициллин-резистентного Staphylococcus aureus [120].
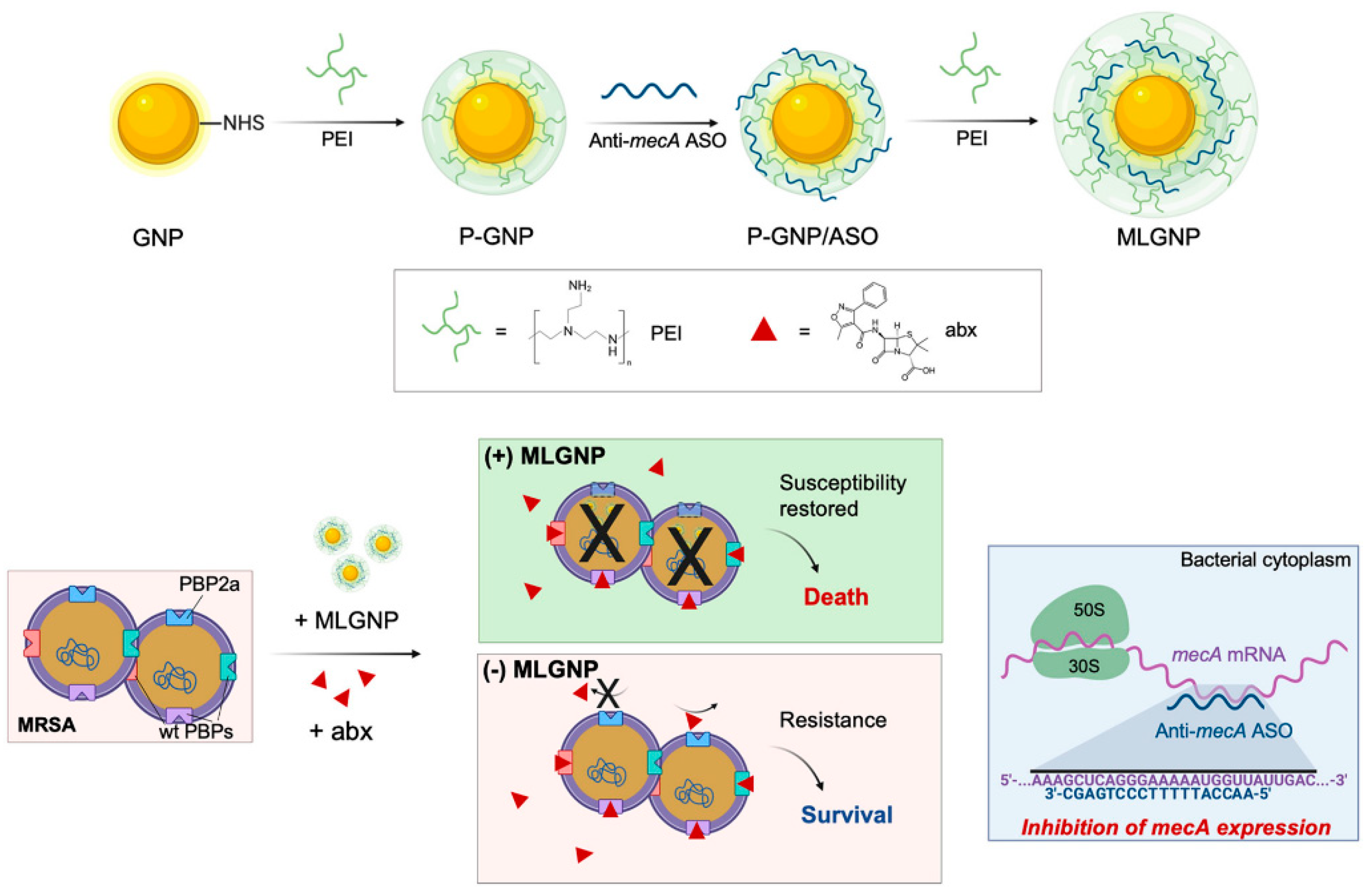 Figure 7. A schematic depiction of how to make ML-AuNPs that deliver antibiotic resistance-targeting ASOs and how to use them to treat MRSA infections in combination (reprinted with permission from [120]). Одноцепочечный ДНК олигонуклеотид , полученный Vinhas et al. [121], избирательно воздействует в K562 клетках на экспрессию гена e14a2 BCR-ABL1. Гены замалчивались очень хорошо с помощью AuNPs, это достоверно увеличивало гибель клеток. Изменения в экспрессии белков BCL-2 и BAX, усиление активности caspase-3 и присутствие апоптических тел в клетках, на которые воздействовали nano conjugate указывают на способность соединений вызывать апоптоз клеток, экспрессирующих K562 BCR-ABL1. Более того, imatinib IC50 [122] снижался, когда вызывающие молчание золотые nano conjugate были скомбинированы с ним.
Kheirandish et al. [122] блокировали ген Leishmania major PTR1 с помощью анти-смысловой плазмиды. Ген PTR1 был подавлен анти-смысловой мРНК. Новый класс не-кодирующих РНК, которые экспрессируются только на внутриклеточной стадии amastigote, был открыт Dumas и другими [123]. Фосфоротиоатные олигонуклеотиды были использованы Ramazeilles et al. [124] для специфического воздействия на последовательность мини-экзонов, которая присутствует на 5' концах мРНК каждого паразита и ранее показала, что голые AuNP обладают анти-лейшманиозными свойствами. Ген L. major GP63 был подавлен. Наблюдалось поглощение ASOs организмом L. major. Согласно исследованию, гибридизированные AuNP могут убивать промастиготы и делать ген GP63 неактивным. Jebali et al. [125] пришли к выводу, что последовательность и размер анти-смыслового олигонуклеотида были важны для трансфекции L. major, вызывающего кожный лейшманиоз. Важно отметить, что эти ASOs могут быть изготовлены как из кодирующих, так и не-кодирующих областей гена GP63. Кроме того, гибридизированные AuNPs могут убивать L. major в дополнение к глушению гена GP63. Был опубликован подробный обзор путей деградации белков при гематологических злокачественных опухолях, в котором изучалось конкретное количество категорий стресса, приводящих к деградации белков и безуспешному лечению [126]. Кроме того, AuNPs потенциально могут помочь в изучении генетических заболеваний. Как уже указывалось, значительные исследования по поглощению важных сигнальных путей с помощью клеток MG-63 с золото-ариловыми NPs провели Abdulwahab и другие [127]. Они предположили, что эти частицы могут быть пригодны для доставки лекарств и для отслеживания в процессе их разработки. Поскольку они не влияли на биологические процессы раковых клеток остеосаркомы, эти золото-ариловые NPs могут быть эффективны для введения лекарств пациентам с этим заболеванием. Это ключевая зацепка для дальнейших исследований в области наследственных заболеваний.
4. Future Perspective
Хотя во всем мире ведутся как доклинические работы, так и клинические испытания, направленные на лечебную терапию, клинический перевод CRISPR/Cas9-опосредованной коррекции генов или других генных коррекций связан с непредсказуемыми результатами [128]. Тем не менее, они показывают их перспективность для медицинских исследований, и, что важно, несколько клинических испытаний в настоящее время находятся в фазе I или фазе II. Примечательно, что технология терапевтического редактирования генов в настоящее время распространяется на спорный с этической точки зрения вопрос изменения генома человеческих эмбрионов на ранней стадии развития для защиты их от ВИЧ-инфекции [129]. Это вселяет в исследователей большой оптимизм в отношении лечения смертельных заболеваний человека.
5. Conclusions
AuNP-опосредованная генотерапия уже продемонстрировала большой потенциал в создании моделей заболеваний для коррекции и подавления мутаций моногенных заболеваний. Изучение особой и уникальной природы AuNPs значительно облегчит их использование для доставки грузов или исправления генных мутаций. Однако для получения точного результата необходимы детальное изучение и оптимизация. Приведенные здесь новые методы свидетельствуют о многочисленных перспективных преимуществах использования нано-носителей для замалчивания активности генов и редактирования генов. Как и предполагалось в предыдущих исследованиях, мы продемонстрировали, как активные методы целенаправленного воздействия на основе многофункциональных наночастиц, такие как совместная доставка других лекарств, улавливание AuNPs в органических композитах для защиты или адресной доставки, а также фототермическое высвобождение, например, могут быть применены в генотерапии. Однако нам еще предстоит провести более глубокие исследования и проанализировать их результаты, прежде чем мы сможем добиться ощутимых результатов.
|






