Система CRISPR (Clustered regularly interspaced short palindromic repeat) - это естественно приобретенная иммунная система, которая предотвращает вторжение вирусов и фагов посредством комбинации с CRISPR-ассоциированными (Cas) белками [1]. Согласно классификации 2020 года, CRISPR/Cas системы включают 2 класса, 6 типов и 33 подтипа [2]. В системах CRISPR/Cas класса 1 (включая тип I, тип III и тип IV) эффекторный модуль состоит из многих субъединичных эффекторных комплексов (таких как Cas3, Cas5-Cas8, Cas10 и Cas11). Напротив, эффекторный модуль систем CRISPR/Cas класса 2 (включая тип II, тип V и тип VI) представлен одиночными крупными белковыми эффекторами со многими доменами (такими как Cas9, Cas12 и Cas13). Системы CRISPR/Cas, состоящие из последовательностей генов Cas, протоспейсера, последовательностей прямого повтора и спейсерных (разграничительных) последовательностей, могут специфически распознавать чужеродные молекулы нуклеиновых кислот с помощью CRISPR РНК (crRNAs), а затем расщеплять их с помощью белков Cas. Поскольку спейсерные последовательности могут быть легко изменены для введения двунитевого разрыва в заданную последовательность, технология на основе CRISPR широко используется в редактировании генома, регуляции транскрипции генов, эпигенетической инженерии и многих других областях [3]. В настоящее время три эффектора класса 2, Cas9, Cas12 и Cas13, широко применяются во многих областях благодаря своей высокой чувствительности, высокой специфичности и простоте управления. Системы редактирования генома, представленные CRISPR/Cas9, успешно применяются в сельском хозяйстве, медицине, биологии, например, для создания новых методов селекции, разработки новых генных препаратов и исследования биологических путей. После углубленного изучения, другие типы Cas белков, такие как Cas13a и Cas12a, были последовательно разработаны и применены в геномной инженерии, в обнаружении нуклеиновых кислот и молекулярной диагностике. Cas12a, также известная как Cpf1, представляет собой эндонуклеазу, направляемую одиночной crRNA, с одним доменом RuvC и Nuc, которые отвечает за разрезание целевых ДНК, прилегающих к PAM-последовательностям, и генерирует концы ДНК с 5' довеском [4]. Системы CRISPR/Cas типа V отличаются наличием одного РНК-направляемого нуклеазного домена RuvC с одной эффекторной молекулой. Cas12a, первая система CRISPR/Cas V типа, была продемонстрирована как двойная нуклеаза с эндорибонуклеазной и эндонуклеазной активностью, которая специфична для биогенеза crRNA и интерференции ДНК-мишени [5]. Тогда как, CRISPR/Cas12a обладает как cis-, так и trans-расщепляющей активностью в отношении одноцепочечной ДНК (ssDNA), что еще больше расширяет возможности её применения [6]. Впоследствии один за другим были идентифицированы другие подтипы белков Cas типа V, такие как Cas12b (C2c1) [7, 8], Cas12c (C2c3) [8], Cas12f (Cas14) [9] и так далее. Недавно методы на основе CRISPR/Cas12 с высокой чувствительностью и специфичностью были использованы для обнаружения нуклеиновых кислот и диагностики на основе CRISPR (CRISPR-Dx) [3]. По сравнению с Cas13, методы на основе Cas12 более популярны из-за меньшего количества этапов амплификации целевой нуклеиновой кислоты и транс-расщепления зондов ssDNA. Кроме того, редактирование генома с помощью системы CRISPR/Cas12 широко применяется у человека, животных и растений. Хотя методы CRISPR-Dx на основе Cas12 и их применение уже были рассмотрены [3], новейшие методы обнаружения и их применение в редактировании генома все еще нуждаются в дальнейшей иллюстрации. В данной статье обобщены области применения системы CRISPR/Cas12, включая применение в детекции нуклеиновых кислот и молекулярной диагностике, редактировании генома животных, растений и микроорганизмов, что может послужить важным ориентиром для дальнейших исследований и использования CRISPR/Cas12 в других новых областях.
CRISPR/Cas12-based nucleic acid detection
Выступая в качестве носителя генетической информации, нуклеиновые кислоты становятся одной из важнейших областей исследований для развития технологий обнаружения ДНК и РНК. Предыдущие технологии обнаружения и визуализации в основном основаны на традиционных методах, таких как амплификация in vitro, белковая гибридизация и микрочипы. Хотя эти методы могут удовлетворять требования к обнаружению и визуализации мишеней, они все еще имеют некоторые недостатки, связанные с временными затратами, высокой стоимостью, низкой точностью и чувствительностью. Методы обнаружения на основе Cas12, такие как DETECTR (ДНК-эндонуклеаза, нацеленная на CRISPR-трансрепортер) [10], HOLMES (одночасовая недорогая многоцелевая высокоэффективная система) [11], HOLMESv2 (улучшенная версия HOLMES) [12], CDetection (Cas12b-опосредованное обнаружение ДНК) [13] и Cas12aVDet (визуальное обнаружение на основе Cas12a) [14], были успешно применены для быстрого, высокочувствительного и специфичного обнаружения различных патогенов [3]. Совсем недавно (2021-2022 гг.) для обнаружения вируса гепатита В (HBV), сальмонеллы, микобактерий, COVID-19 и других патогенов были применены новейшие методы обнаружения с экономией времени, низкой стоимостью, высокой чувствительностью и специфичностью, такие как LAMP-Cas12a, G-CRISPR-Cas [15], LACD [16], CLAP [17] и vis-NEAA [18] и др.
Для выявления HBV был разработан метод LAMP-Cas12a (LAMP - петлевая изотермическая амплификация в сочетании с системой обнаружения CRISPR/Cas12a), который инновационно решил проблемы, связанные с проведением анализа в условиях медицинского пункта и c выделением нуклеиновой кислоты из образцов. На основе LAMP-Cas12a для обнаружения HBV была достигнута визуализация результатов анализа и предел обнаружения (LOD) 1 копия/мкл в течение 13 минут. При этом чувствительность и специфичность при оценке 73 клинических образцов составили 100%. Анализ HBV на основе LAMP-Cas12a обеспечивает быстрые, точные результаты теста и низкую стоимость без использования специализированного оборудования, что имеет важное практическое значение для выявления HBV в пунктах медицинской помощи [19]. В отличие от этого, G-CRISPR-Cas (G-quadruplex-probing CRISPR/Cas12 system), анализ без метки, был использован для обнаружения патогена пищевого происхождения, Salmonella enterica (
S. enterica). Введение G-квадруплексного зонда в качестве субстрата для Cas12a позволило проводить анализ пищевых патогенов без метки. С помощью процесса амплификации, индуцированного LAMP, G-CRISPR-Cas достиг высокочувствительного обнаружения
S. enterica на уровне 20 КОЕ (колониеобразующих единиц). В то же время, двойное распознавание праймеров LAMP и Cas12a-направляемой РНК обеспечило специфичность обнаружения патогенных генов. Таким образом, G-CRISPR-Cas анализ полезен для обнаружения на месте инфекции или загрязнения патогенами пищевого происхождения, что обеспечивает гарантию безопасности пищевых продуктов [15]. Как и G-CRISPR-Cas, vis-NEAA (CRISPR/Cas12a в сочетании с никинг-энзим- опровождаемой амплификацией) был использован для обнаружения
Salmonella в продуктах питания. CRISPR/Cas12a может специфически идентифицировать ампликоны NEAA и преобразовывать сигнал во флуоресцентные визуальные показания, тем самым обладая преимуществами быстроты и высокой эффективности метода NEEA, и достигая 100% достоверности в то же время. Что еще более важно, он решил проблему неспецифической амплификации метода NEAA. С помощью анализа vis-NEAA сальмонеллы с 80 КОЕ/мл в пролитых яйцах могут быть обнаружены на месте в течение 20 минут [18]. В совокупности, как G-CRISPR-Cas, так и vis-NEAA могут быть использованы для обнаружения патогенов пищевого происхождения, обеспечивая тем самым безопасность продуктов питания. LACD (LAMP, соединенный с CRISPR/Cas12a-опосредованная диагностика) была разработана для обнаружения комплекса
Mycobacterium tuberculosis (MTC) при туберкулезе человека (ТБ). Поскольку разработанные праймеры LAMP содержали специфический сайт PAM для распознавания с помощью CRISPR/Cas12a, их можно использовать для обнаружения любой целевой последовательности, даже мишеней без сайтов PAM, что подает новую идею для применения Cas12a и расширяет область её применения [16]. Колориметрический анализ на основе AuNP в сочетании с Cas12 и RT-LAMP, также называемый Cas12a-assisted RT-LAMP/AuNP (CLAP), представляет собой быстрый, чувствительный и визуальный анализ для обнаружения SARS-CoV-2. При оптимальных условиях обнаружение РНК SARS-CoV-2 может быть снижено до 4 копий/µL в течение 40 минут невооруженным глазом. Кроме того, такие преимущества, как высокая специфичность, простота эксплуатации, высокая пропускная способность обнаружения, делают его пригодным для крупномасштабного скрининга населения на SARS-CoV-2 в общественных местах, что способствует контролю и смягчению пандемии COVID-19. Таким образом, метод CLAP играет важную практическую роль в скрининге населения на COVID-19 [17]. Таким образом, эти новейшие методы используют низкие требования к оборудованию LAMP и высокую расщепляющую активность Cas12a, благодаря чему они имеют широкие перспективы применения благодаря быстроте, высокой чувствительности, специфичности и точности, высокой пропускной способности и простоте работы. Следует отметить, что среди методов детекции на основе Cas12, RPA (recombinant enzyme polymerase amplification), RCA (rolling circle amplification), and PCR (including rapid PCR, rRT PCR, and asymmetric PCR, Таблица 1) также могут быть использованы для экспоненциальной амплификации целевых молекул ДНК. С помощью RPA, CDetection и DETECTR можно достичь attomolar (âM) чувствительности для обнаружения ДНК (Таблица 1). Характеристики и области применения основных анализов CRISPR/Cas12, разработанных в последние годы, перечислены в таблице 1.
Table 1 The characteristics and applications of CRISPR/Cas12-based assays
CRISPR/Cas12 system involves in genome editing
Как РНК-направляемые эндонуклеазы, CRISPR/Cas9 и Cas12a широко используются для редактирования генома у животных, растений и культивируемых клеток, основываясь на их программируемой способности запускать репарацию ДНК в нужных местах, тем самым ускоряя темпы фундаментальных исследований и обеспечивая клинические и сельскохозяйственные прорывы [30, 31]. Между тем, Cas12b также является мощным инструментом для геномной инженерии благодаря малому размеру и высокой специфичности [32-34].
CRISPR/Cas12 system involves in genome editing of human and animals
Как и вторая система CRISPR/Cas для редактирования генома млекопитающих, Cas12a распознает PAM-последовательность 5'-TTN, что улучшает диапазон распознавания генома по сравнению с PAM-последовательностью Cas9, распознающей 5'-NGG. Системы CRISPR/Cas12a и Cas9 дополняют друг друга и еще больше ускоряют развитие инструментов редактирования генома CRISPR. В 2017 году LbCas12a-опосредованное редактирование генома было успешно использовано для индуцированных плюрипотентных стволовых клеток (IPSCs) от пациентов с мышечной дистрофией Дюшенна (DMD) и коррекции целевых генов DMD в мышиных эмбрионах, что стало важным вкладом в коррекцию DMD в генотерапии [35]. В том же году, используя способность Cas12a обрабатывать собственную crRNA, группа Zhang Feng's осуществила одновременное редактирование до четырех генов в клетках млекопитающих и трех генов в мозге мыши [36]. Более того, Liu et al. подтвердили, что сконструированные варианты Cas12a с двумя различными последовательностями ядерной локализации (NLS) на С-конце могут повысить эффективность мутагенеза LbCas12a и FnoCas12a у млекопитающих, что обеспечивает схему для расширения применения Cas12a у позвоночных [37]. Кроме того, AsCas12a и LbCas12a были использованы для редактирования генома эмбрионов мыши, дрозофилы и рыбок данио благодаря своей высокой активности, но низкий охват генома и низкая эффективность нацеливания препятствуют их применению в биомедицинских областях [38].
CRISPR/Cas12b/C2c1 (тип V-B) - это эндонуклеаза ДНК с двойным наведением на РНК, которая содержит RuvC-подобный эндонуклеазный домен, отдаленно связанный с Cas12a, и полагается как на crRNA, так и на tracrRNA для расщепления ДНК [7, 8]. Оптимальная расщепляющая активность Cas12b из
Alicyclobacillus acidiphilus (AaCas12b) поддерживается в широком диапазоне температур (31 ~ 59 °C), наряду с небольшим размером, высокой специфичностью, повышенной стабильностью и минимальными вне-целевыми эффектами, что делает её пригодной для редактирования генома млекопитающих и клинического применения, включая одно- и мультиплексное редактирование генома, активацию генов и создание генных мутантных мышиных моделей, что позволяет предположить, что CRISPR/Cas12b может быть использован в качестве универсального инструмента для геномной инженерии млекопитающих [33, 39]. Впоследствии Strecker et al. определили перспективного кандидата Cas12b для редактирования генома человека из
Bacillus hisashii (BhCas12b) и получили мутацию усиления функции BhCas12b. Результаты показали, что мутант BhCas12b способствует редактированию генома
in vitro в клеточных линиях человека и первичных Т-клетках человека и демонстрирует более высокую специфичность. Эта работа подтвердила, что Cas12b может быть использована для редактирования генома клеток человека [32]. Совсем недавно Un1Cas12f1 (тип V-I) была переработана и оптимизирована для редактирования генома в клетках человека. Результаты показали, что оптимизированная система Un1Cas12f1 позволяет эффективно и специфично редактировать геном в клетках человека с эффективностью, сравнимой с SpCas9, и специфичностью, аналогичной таковой AsCas12a [40]. Эти наблюдения показывают, что CRISPR/Cas12 можно использовать как универсальный инструмент для редактирования генома млекопитающих (табл. 2).
Table 2 The applications, characteristics, and advantages of CRISPR/Cas12 system in genome editing of human and animals
CRISPR/Cas12 system involves in genome editing of plants
CRISPR/LbCas12a - это термочувствительная система редактирования генома растений, которая успешно применяется в рисе, Arabidopsis, кукурузе, соевых бобах и других видах [46]. Температурная устойчивость и способность Cas12a к точному разрезанию открывают новые перспективы для создания культур без ГМО (генетически модифицированных организмов) с ценными признаками. В рисе средняя частота мутаций в целевых сайтах составила 47,2%, это указывает на то, что FnCas12a может эффективно вызывать генные мутации [47]. Впоследствии Zhong et al. использовали рис в качестве модельной системы для изучения требований к PAM для FnCas12a при редактировании генома растений и предположили, что FnCas12a предпочитает TTTV PAM для эффективного редактирования генома в рисе [48]. AsCas12a была успешно использована для индуцирования наследственных мутаций с частотой 77,8% и 92,8% на двух целевых сайтах среди линий T0 риса [49]. В трансгенной кукурузе редактирование генома на основе LbCas12a достигло 100% частоты при дневной температуре 28 °C [49]. В настоящее время Cas12a также используется для редактирования генома древесных растений. Было доказано, что CRISPR/AsCas12a наиболее эффективна при одновременном нокауте членов многогенных семейств, что восполняет недостаток мутантов древесных растений и способствует исследованиям в области лесной генетики [50]. Редактирование кодирующих последовательностей генов GhPGF и GhCLA1 с помощью CRISPR/LbCas12a позволяет точно редактировать тетраплоидные хлопчатники (Gossypium hirsutum). Результаты показали, что были успешно созданы нетрансгенные и свободные от gossypol хлопчатники, которые предоставили ценные ресурсы зародышевой плазмы для молекулярной селекции хлопчатника [46].
Система CRISPR/Cas12b доказала свою эффективность в редактировании генома растений. AacCas12b и AaCas12b против OsEPFL9-sgRNA02 были перенесены в каллус риса путем трансформации, опосредованной
Agrobacterium tumefaciens. Уровень мутации трансгенной линии AacCas12b T
0 составил 36,4%, а AaCas12b - 54,2%, что позволяет эффективно генерировать стабильные мутанты риса [34]. Кроме того, были изучены потенциальные возможности применения CRISPR/Cas12b в Arabidopsis. С помощью BvCas12b и BhCas12b v4 было получено большое количество делеций в многочисленных сайтах арабидопсиса, и были успешно получены стабильные мутанты без очевидных мутаций в потенциальных внецелевых сайтах [51]. Эти результаты прояснили потенциальную полезность системы CRISPR/Cas12b для редактирования генома у риса и Arabidopsis. Области применения, характеристики и преимущества системы CRISPR/Cas12 для редактирования генома растений перечислены в таблице 3. Примечательно, что система CRISPR/Cas12 в основном обеспечивает целенаправленный мутагенез растений посредством инсерций и делеций, а температурная зависимость ограничивает ее применение в редактировании генома растений. В будущем необходимо продолжить изучение и устранение температурной зависимости Cas12a, чтобы облегчить ее использование для редактирования генома других видов.
Table 3 The applications, characteristics, and advantages of CRISPR/Cas12 system in plant genome editing
CRISPR/Cas12 system involves in genome editing of microorganisms
Как универсальный инструмент для редактирования генома, CRISPR/Cas12 также может быть использован для редактирования генов микроорганизмов, включая цианобактерии, бактерии и грибы. Цианобактерии являются фотоавтотрофными микроорганизмами, а также важным модельным организмом для физиологических и экологических исследований. Было доказано, что CRISPR/Cas12a подходит для точного редактирования генома цианобактерий путем гомологичной рекомбинации [56, 57]. Впоследствии было показано, что плазмиды на основе стандартной европейской векторной архитектуры (SEVA) (содержащие систему CRISPR/Cas12a) эффективны для редактирования генома различных родов цианобактерий [57]. Аналогичным образом,
Mycolicibacterium neoaurum ATCC 25,795, классическая бактерия, производящая ценные стероидные препараты, подвержена эффективным и точным генетическим манипуляциям с помощью системы CRISPR/Cas12a. Liu et al. подтвердили, что система CRISPR/Cas12a обладает большим потенциалом в точном редактировании генома
M. neoaurum, таком как интеграция генов мишеней в нужные участки и целенаправленное удаление последовательностей ДНК различной длины [58]. Недавно было доказано, что CRISPR/Cas12a может одновременно редактировать гены
pyrG, pksP и kusA Aspergillus aculeatus TBRC 277 (промышленно родственной фабрики клеток) с эффективностью до 40% [59]. Кроме того, CRISPR/Cas12-опосредованное редактирование микробного генома в основном используется для улучшения штаммов, например, для производства ценных стероидных фармацевтических препаратов [58] и биопродуктов [59], а также для высокоэффективных каркасов (chassis) [60], и для фундаментальных исследований, например, для изучения взаимодействия растений и грибов [61, 62] и патогенеза важных условно-патогенных микроорганизмов [63] (Таблица 4). Для простоты понимания, основываясь на существующих отчетах, CRISPR/Cas12-опосредованное редактирование генома было представлено на рис. 1.
Table 4 Применение, характеристики и преимущества системы CRISPR/Cas12 в редактировании генома микроорганизмов
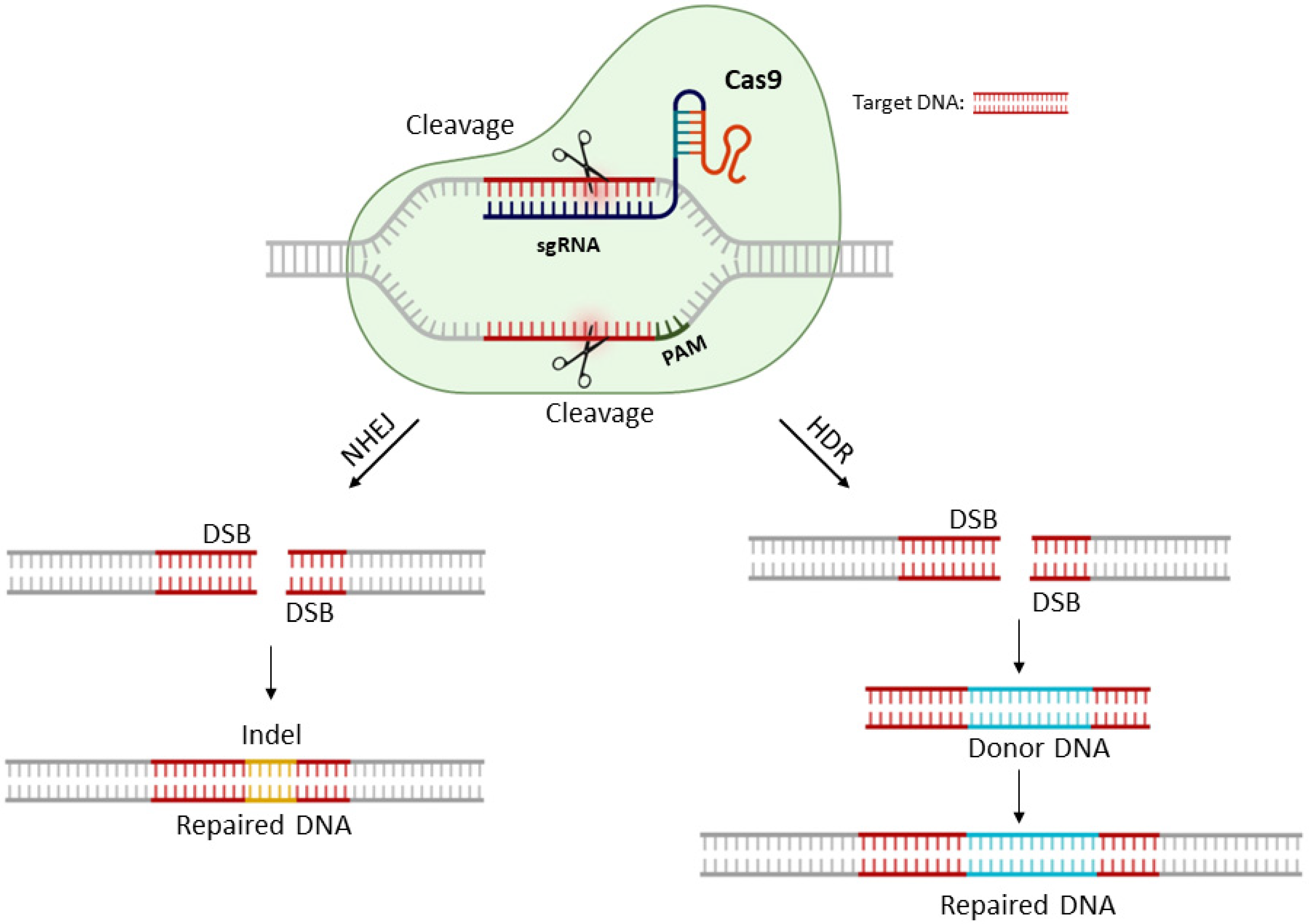
Fig. 1
CRISPR/Cas12-mediated genome editing of animals, plants and microorganisms
The other Cas12 proteins and their applications
Как показано в таблице 5, Cas белки типа V можно разделить на 11 подтипов, включая подтип V-A (Cas12a), подтип V-B (Cas12b), подтип V-C (Cas12c), подтип V-D (Cas12d), подтип V-E (Cas12e), подтип V-F (Cas12f), подтип V-G (Cas12g), подтип V-H (Cas12h), подтип V-I (Cas12i), подтип V-K (Cas12k) и подтип V-U [2]. Белки CRISPR/Cas12c (C2c3) и Cas12d (CasY) представляют компактные CRISPR/Cas системы, которые имеют ограниченную последовательную гомологию с crRNAs из Cas12a и Cas9 [66]. Исследование показало, что для катализируемого с помощью Cas12d расщепления ДНК требуется короткая комплементарная нетранслируемая РНК (scoutRNA) и crRNA, такая scoutRNA является важным кофактором для Cas12c-катализируемого созревания пре-crRNA. Cas12c может применяться для обнаружения патогенов растений и идентификации однонуклеотидных полиморфизмов (SNP). Кроме того, Cas12d может усиливать РНК-направленную ДНК-интерференцию в бактериях [66]. Cas12e (CasX) - это РНК-направляемая ДНК-эндонуклеаза, которая изменяет геномы человека, мыши, дрозофилы, дрожжей, кишечной палочки и других модельных организмов, тем самым обладая потенциалом универсального редактора генома [67]. Миниатюрная Cas12f1 является РНК-направляемой эндонуклеазой, которая была продемонстрирована как эффективный инструмент редактирования генома в бактериях и клетках человека [68]. Cas12g - это РНК-направляемая рибонуклеаза, которая расщепляет одноцепочечные РНК (ssRNA) и ssDNA, нацеливаясь на субстрат ssRNA. Система CRISPR/Cas12g представляет собой перспективную платформу для редактирования РНК и обнаружения нуклеиновых кислот благодаря небольшому молекулярному весу и высокой термической стабильности белка Cas12g [69]. Cas12i, эффектор CRISPR/Cas подтипа V-I, является эндонуклеазой, которая преимущественно распознает и расщепляет нецелевую нить 28 п.н. в двухцепочечной ДНК (dsDNA) субстрата. По сравнению с субстратом dsDNA длиной 20 п.н., распознаваемым Cas9, Cas12a, Cas12b и Cas12e, Cas12i имеет потенциал для использования в качестве высокоточного редактора генома [70]. Cas12k, кодируемая цианобактериальным транспозоном
Scytonema hofmannisystem Tn7-like, не обладает эндонуклеазной активностью и опосредует зависимую от направляющей РНК транспозицию [2, 71]. Благодаря комбинации транспозазы с эффектором CRISPR Cas12k фрагменты ДНК могут непосредственно интегрироваться в целевые сайты с частотой 80%, что заложило основу для точной вставки ДНК [71]. Querques et al. продемонстрировали возможность использования CRISPR-ассоциированных транспозонов в качестве инструмента программируемой сайт-специфической вставки генов [72]. Функции белков Cas12 подтипов V-H и V-U нуждаются в дальнейшем изучении. Классификации и области применения системы CRISPR/Cas12 перечислены в таблице 5.
Table 5 The classifications, characteristics and functions of Cas12 proteins [2]
Следует отметить, что помимо вышеупомянутых функций, Cas12 также участвует в регуляции генов посредством CRISPR-интерференции (CRISPRi) [64, 75]. Недавнее исследование показало, что CRISPRi может эффективно (более 90%) достигать транскрипционного ингибирования целевых генов [64]. Вместе взятые, эти результаты могут улучшить наше понимание функционального разнообразия системы CRISPR/Cas12. С дальнейшими исследованиями перспективы применения Cas12 будут все более широкими.
Conclusion
Технология CRISPR/Cas, как наиболее часто используемый инструмент редактирования генома, известна как "волшебные ножницы" для редактирования генома из-за своей простоты, дешевизны и высокой эффективности, что позволяет исследователям эффективно и точно изменять, редактировать или заменять гены у растений, животных и даже человека. В настоящее время усовершенствованная технология CRISPR/Cas широко применяется для выведения новых сортов животных и растений, а также в биомедицинских областях, таких как поиск генов, связанных с сигнальными путями, скрининг лекарственных мишеней и генотерапия. Несомненно, CRISPR/Cas-опосредованное редактирование генома in vivo имеет определенные внецелевые эффекты, которые могут привести к потере больших фрагментов ДНК на дистальном конце сайта расщепления и даже к другим более сложным генным мутациям [76, 77]. Однако с дальнейшим развитием, модификацией и усовершенствованием технологии CRISPR/Cas вышеупомянутые проблемы будут постепенно решены. Между тем, на основе системы CRISPR/Cas в сочетании с изотермическим усилением, электрохимическим сенсором, оптической визуализацией и другими технологиями исследователями были созданы новые биосенсоры с высокой специфичностью и чувствительностью, а также быстротой, простотой и удобством, которые широко применяются в области обнаружения и визуализации заболеваний, выявления различных маркеров заболеваний, что позволяет обеспечить высокую точность и надежность диагностики заболеваний на молекулярном уровне. Недавно Ivanov et al. разработали платформу для определения активности trans-cleavage Cas12 на основе латерального проточного теста (LFT), причем результат анализа зависит только от композитного ДНК-IgG зонда [29]. В будущем разработка платформы для обнаружения зондов на основе CRISPR/Cas12 имеет большие перспективы. Кроме того, новый инструмент редактирования РНК Cas7-11 может быть слит вместе для редактирования генома, что может быть использовано для регенерации тканей и создания противовирусных препаратов [78]. Cas12k не обладает нуклеазной активностью и опосредует только направляющую РНК-зависимую транспозицию [2, 79]. Развитие инженерии транспозазных компонентов может расширить их применение в эукариотических клетках в будущем. В одном из последних исследований был сделан неожиданный вывод о том, что разработанное ДНК-устройство CRISPR/Cas12 может разрушать нативную хромосому и превращать бактериальные клетки в биосинтетические каркасы для высокоэффективного молекулярного биопроизводства [80]. Как следствие, благодаря неустанным усилиям исследователей со всего мира, новые функции и новые типы белков Cas будут открыты и расшифрованы, что позволит Как следствие, благодаря неустанным усилиям исследователей со всего мира, новые функции и новые типы белков Cas будут открыты и расшифрованы, что еще больше расширит их разнообразное биотехнологическое применение, чтобы лучше использовать систему CRISPR/Cas на благо человека.
 Fig. 1
Fig. 1