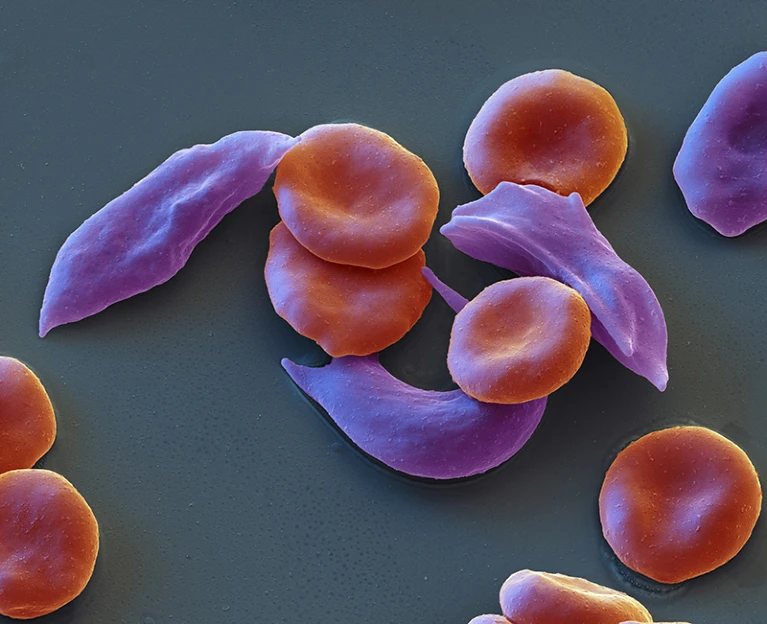
 Coloured scanning electron micrograph of red blood cells affected by sickle-cell anaemia.
Sickle-cell anaemia is marked by red blood cells that are misshapen and sticky, affecting blood flow.Credit: Eye Of Science/SPL
Coloured scanning electron micrograph of red blood cells affected by sickle-cell anaemia.
Sickle-cell anaemia is marked by red blood cells that are misshapen and sticky, affecting blood flow.Credit: Eye Of Science/SPL
Впервые в мире британский регулятор лекарственных средств одобрил терапию, использующую в качестве лечения инструмент редактирования генов CRISPR-Cas9. Это решение стало еще одним важным моментом в развитии биотехнологии, которая за десятилетие, прошедшее с момента ее открытия, была признана революционной.
Терапия, получившая название Casgevy, предназначена для лечения заболеваний крови - серповидно-клеточной болезни и β-талассемии. Серповидно-клеточная болезнь, известная также как серповидно-клеточная анемия, может вызывать изнурительные боли, а люди с талассемией часто нуждаются в регулярных переливаниях крови.
"Это знаковое одобрение, которое открывает возможности для дальнейшего применения CRISPR-терапии в будущем для потенциального лечения многих генетических заболеваний", - заявил Kay Davies, генетик из Оксфордского университета (Великобритания), в комментариях для британского Центра научных СМИ (SMC).
What research led to the approval?
Одобрение Агентства по регулированию лекарственных средств и товаров медицинского назначения ( Medicines and Healthcare products Regulatory Agency (MHRA) последовало за многообещающими результатами клинических испытаний, в которых тестировался одноразовый препарат, вводимый путем внутривенной инфузии. Терапия была разработана фармацевтической компанией Vertex Pharmaceuticals (Бостон, штат Массачусетс) и биотехнологической компанией CRISPR Therapeutics (Zug, Switzerland).
В ходе испытаний серповидно-клеточной болезни 29 из 45 участников наблюдались достаточно долго, чтобы подвести промежуточные итоги. Casgevy полностью избавил 28 из них от изнурительных приступов боли в течение как минимум одного года после лечения.
Исследователи также провели испытания препарата для лечения тяжелой формы β-талассемии, которая традиционно лечится переливанием крови примерно раз в месяц. В этом испытании 54 человека получали Casgevy, из них 42 человека участвовали в нем достаточно долго, чтобы получить промежуточные результаты. Из этих 42 участников 39 не нуждались в переливании красных кровяных телец в течение как минимум одного года. У оставшихся трех человек потребность в переливании крови снизилась более чем на 70%.
How does the gene therapy work?
Casgevy использует инструмент редактирования генов CRISPR, разработчики которого в 2020 г. были удостоены Нобелевской премии по химии.
Серповидно-клеточная болезнь и β-талассемия вызываются ошибками в генах, кодирующих гемоглобин - молекулу, которая помогает красным кровяным тельцам переносить кислород по организму.
При серповидно-клеточной болезни аномальный гемоглобин делает клетки крови неправильной формы и липкими, в результате чего они образуют сгустки, которые могут закупоривать кровеносные сосуды. Эти закупорки снижают поступление кислорода к тканям, что может вызывать периоды сильной боли, называемые болевыми кризами.
При мутациях, приводящих к низкому уровню гемоглобина в крови, низкому количеству эритроцитов и таким симптомам, как усталость, одышка и нерегулярное сердцебиение, возникает β-талассемия.
Клиницисты применяют Casgevy путем забора стволовых клеток, продуцирующих кровь, из костного мозга людей, страдающих тем или иным заболеванием, и использования CRISPR-Cas9 для редактирования генов, кодирующих гемоглобин в этих клетках. Этот инструмент редактирования генов основан на молекуле РНК, которая направляет фермент Cas9 к нужному участку ДНК, который фермент разрезает.
Когда Cas9 достигает гена, на который нацелен Casgevy, называемого BCL11A, он разрезает обе нити ДНК. BCL11A обычно предотвращает выработку одной из форм гемоглобина, которая образуется только у плода. Нарушая этот ген, Casgevy запускает производство фетального гемоглобина, который не несет в себе тех же отклонений, что и гемоглобин взрослых людей с серповидно-клеточной болезнью или талассемией.
Прежде чем генны клетки будут введены в организм, человек должен пройти курс лечения, подготавливающий костный мозг к приему модифицированных клеток. После введения стволовые клетки дают начало эритроцитам, содержащим фетальный гемоглобин. Это облегчает симптомы заболевания за счет усиления снабжения тканей кислородом. "Пациентам может потребоваться не менее месяца пребывания в стационаре, пока обработанные клетки приживутся в костном мозге и начнут вырабатывать эритроциты со стабильной формой гемоглобина", - говорится в пресс-релизе MHRA.
How safe is Casgevy?
У участников проводимых исследований наблюдались такие побочные эффекты, как тошнота, усталость, лихорадка и повышенный риск инфекций, однако никаких серьезных проблем с безопасностью выявлено не было. MHRA и производитель следят за безопасностью технологии и опубликуют дальнейшие результаты.
Одно из опасений, связанных с этим подходом, заключается в том, что CRISPR-Cas9 иногда может вносить непреднамеренные генетические изменения с неизвестными побочными эффектами.
"Хорошо известно, что CRISPR может приводить к ложным генетическим модификациям с неизвестными последствиями для обрабатываемых клеток", - заявил SMC David Rueda, генетик из Имперского колледжа Лондона. "Прежде чем делать выводы, необходимо ознакомиться с данными полногеномного секвенирования этих клеток. Тем не менее, это сообщение вселяет в меня осторожный оптимизм".
Will other countries approve the treatments?
Управление по контролю качества пищевых продуктов и лекарственных средств США рассматривает возможность одобрения препарата Casgevy, непатентованное название которого - exa-cel, для лечения серповидно-клеточной болезни; в прошлом месяце состоялось совещание его советников, на котором обсуждалась эта терапия. Европейское агентство по лекарственным средствам также рассматривает возможность применения препарата для лечения обоих заболеваний.
Пока же эта терапия, скорее всего, останется уделом богатых стран с развитой системой здравоохранения. "Возможно, этот метод лечения будет нелегко распространить на страны с низким и средним уровнем дохода, поскольку он требует технологии получения стволовых клеток крови пациента, доставки генетического редактора в эти стволовые клетки и последующей реинъекции этих клеток", - сказал Simon Waddington, генетик из Университетского колледжа Лондона в интервью SMC. Это не "готовое" лекарство, которое можно легко ввести или принять в виде таблеток", - говорит он.
How much will it cost?
Даже там, где препарат получит одобрение, высокая стоимость Casgevy, скорее всего, ограничит круг тех, кто сможет им воспользоваться.
"Проблема заключается в том, что эти методы лечения будут очень дорогими, поэтому ключевое значение имеет способ сделать их более доступными во всем мире", - говорит Davies.
Цена лечения в Великобритании еще не определена, но, по оценкам, она может составлять около 2 млн. долл. на одного пациента, что соответствует ценам на другие генотерапии.
"В настоящее время мы не установили прейскурантную цену для Великобритании и сосредоточились на работе с органами здравоохранения, чтобы как можно скорее обеспечить возмещение расходов и доступ к препарату для пациентов, имеющих на него право", - заявил представитель компании Vertex в интервью Nature.
|
 Coloured scanning electron micrograph of red blood cells affected by sickle-cell anaemia.
Sickle-cell anaemia is marked by red blood cells that are misshapen and sticky, affecting blood flow.Credit: Eye Of Science/SPL
Coloured scanning electron micrograph of red blood cells affected by sickle-cell anaemia.
Sickle-cell anaemia is marked by red blood cells that are misshapen and sticky, affecting blood flow.Credit: Eye Of Science/SPL