Посещений: 
РАЗРАБОТКА НАНО-ЧАСТИЦ, НАНО-ИНЖЕНЕРИЯ
Противоопухолевая терапия
Novel Development of Nanoparticles—A Promising Direction for Precise Tumor Management Dengke Zhang, Qingqing Tang, Juan Chen et al.
 Pharmaceutics 2023, 15(1), 24; https://doi.org/10.3390/pharmaceutics15010024
|
Although the clinical application of nanoparticles is still limited by biological barriers and distribution, with the deepening of our understanding of nanoparticles over the past decades, people are gradually breaking through the previous limitations in the diagnosis and treatment of tumors, providing novel strategies for clinical decision makers. The transition of nanoparticles from passive targeting to active tumor-targeting by abundant surface-modified nanoparticles is also a development process of precision cancer treatment. Different particles can be used as targeted delivery tools of antitumor drugs. The mechanism of gold nanoparticles inducing apoptosis and cycle arrest of tumor cells has been discovered. Moreover, the unique photothermal effect of gold nanoparticles may be widely used in tumor therapy in the future, with less side effects on surrounding tissues. Lipid-based nanoparticles are expected to overcome the blood-brain barrier due to their special characteristics, while polymer-based nanoparticles show better biocompatibility and lower toxicity. In this paper, we discuss the development of nanoparticles in tumor therapy and the challenges that need to be addressed.

|
Среди стратегий лечения рака самыми основными методами являются хирургия, радиотерапия, химиотерапия и иммунотерапия. Благодаря постоянной стандартизации и продвижению планов лечения рака, общая смертность от рака имеет тенденцию к снижению; общий уровень смертности от рака снизился на 29% по сравнению с пиком в 1991 году, но общее число смертей все еще велико: по оценкам, в 2022 году в Америке будет 609 360 смертей от рака [1]. Большое количество смертей, связанных с раком, частично объясняется неточностью терапевтических методов и вызванными ими побочными эффектами. Например, во время радиотерапии радиация может вызвать пневмонию и дерматит из-за повреждения здоровых окружающих тканей; во время системной химиотерапии нормальные ткани, такие как эпителий слизистой оболочки и кроветворные ткани костного мозга, будут сильно повреждены, так как химиотерапевтические препараты не могут отличить злокачественные клетки от этих клеток [2]. Это приведет к снижению терапевтического эффекта. В связи с этим необходимо продолжить исследования наночастиц, нацеленных на опухоли, чтобы разработать новые стратегии лечения рака.
2. Targeting Mechanism of Nanoparticles
2.1. Passive Targeting of Nanoparticles
Молекулы нанометрового масштаба наделяют наночастицы особым свойством - enhanced permeability and retention (EPR) [3]. При солидных опухолях капиллярные сплетения в них аномальны и дезорганизованы; плотность этих капилляров увеличена, при этом значительно повышена проницаемость, что позволяет наночастицам с молекулярным диаметром 100-800 нм проникать в опухолевую ткань [4]. В отличие от этого, эндотелий питательных сосудов нормальной ткани тесно организован. Между тем, очистительная функция лимфатических сосудов в опухолевой ткани нарушена, что приводит к длительному удержанию наночастиц, что является одной из причин иммунного избегания опухоли [5]. Как показано на рисунке 1 ниже, разница в расположении эндотелиальных клеток сосудов между опухолевой и нормальной тканями приводит к этому особому свойству опухоли. Однако этот механизм целенаправленного воздействия ограничен биологическим распределением in vivo, неспецифическим поглощением нормальными тканями, степенью васкуляризации опухоли и кровотоком сосудов. В плазме циркулирующие наночастицы адсорбируются и опсонизируются альбумином, компонентами комплемента, иммуноглобулинами и другими белками плазмы, а затем интернализуются mononuclear phagocytic system (MPS), главным образом в печени, лимфатических узлах и селезенке [6]. Предполагается, что наночастицы размером 100-200 нм обладают превосходным эффектом EPR, что также может помочь им в наибольшей степени избежать фильтрационной ловушки печени и селезенки [5]. Более того, при аденокарциноме протоков поджелудочной железы, характеризующейся недостаточной васкуляризацией и несолидными опухолями, трудно нацелить наночастицы на опухолевые клетки [7].
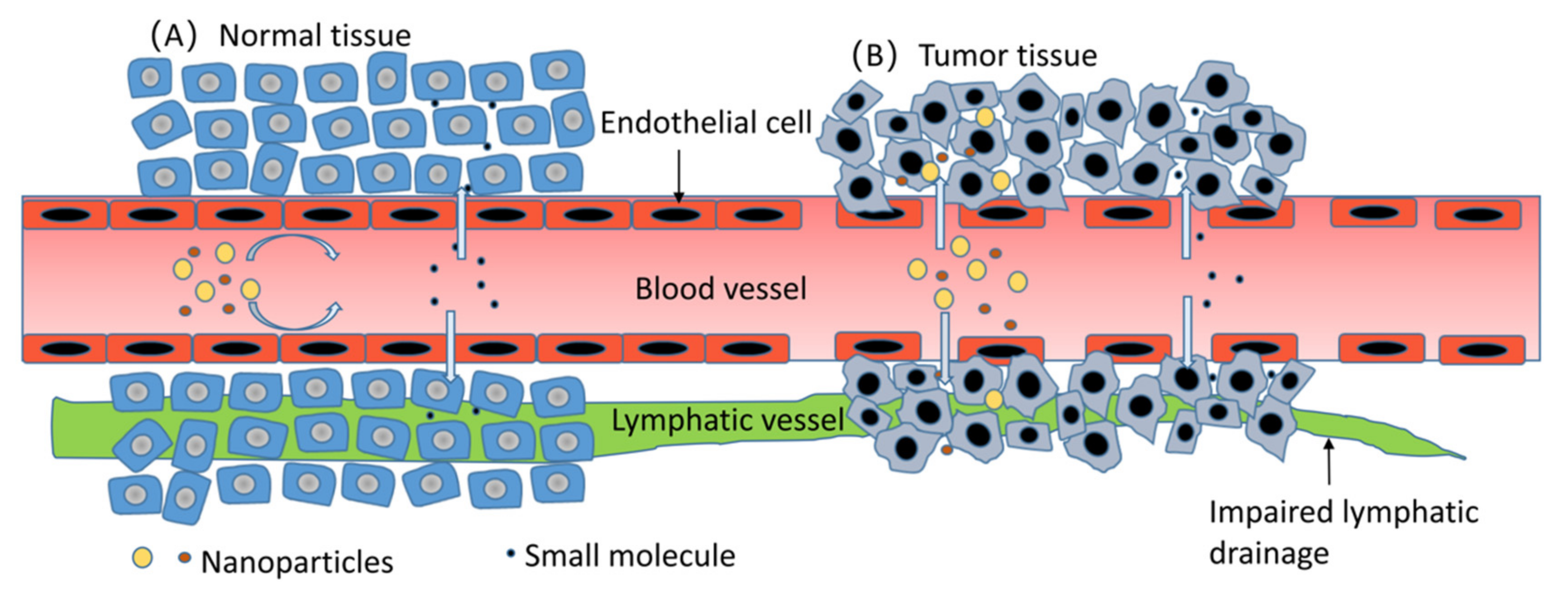 Figure 1. Compared with the tumor tissue in (B), the nutrient vascular epithelial cells in the normal tissue in (A) are arranged very closely, and only small molecules are easy to pass through; however, in (B), nanoparticles with a molecular diameter of 100-800 nm can smoothly pass through the nutrient vessels into the tumor tissue [4]. Moreover, there are few lymphoid tissues or only drainage-damaged lymphatic vessels in the tumor tissue, and the nanoparticles' clearance will also be reduced [5]. 2.2. Active Tumor-Targeting Mechanism of Nanoparticles
Многие рецепторы, такие как рецепторы эпидермального фактора роста (EGFRs), рецепторы фактора роста эндотелия сосудов (VEGFRs) и рецепторы фолиевой кислоты, принадлежащие нормальным клеткам, экспрессировались на поверхности опухолевых клеток; кроме того, на поверхности экспрессируются специфические знаковые полипептиды и белки. Поэтому эти участки становятся мишенями для модифицированных наночастиц соответствующими лигандами для "слежения" за опухолевыми клетками. Основными выявленными мишенями являются следующие категории.
2.2.1. Human Epidermal Growth Factor Receptors (HERs)
HERs - это тирозин-киназные рецепторы, принадлежащие к семейству онкогенов B эритробластической лейкемии, которые влияют на пролиферацию нормальных клеток, прогрессию опухоли и инвазию [8]. HER1, также известный как рецептор эпидермального фактора роста (EGFRs), избыточно экспрессируется, особенно при не-мелкоклеточном раке легкого [9]. HER2 - еще один представитель этого семейства. По оценкам, избыточная экспрессия HER2 встречается в 15-30 % случаев рака молочной железы и в 10-30 % случаев рака желудка. Экспрессия HER2 предполагает плохой клинический исход, что также делает его привлекательной мишенью для лечения и разработки наночастиц [10].
2.2.2. Vascular Endothelial Growth Factor Receptors (VEGFRs)
Процесс роста большинства солидных опухолей сопровождается аномальной неоваскуляризацией, при этом сосудистые эндотелиальные факторы роста (VEGFs) индуцируются гипоксическим микроокружением опухоли [11]. В дополнение к вазогенной роли VEGF/VEGFR, есть доказательства того, что VEGFR 1 участвует в метастазировании клеток колоректальной карциномы [11]. Более того, VEGF/VEGFR подавляет функцию Т-лимфоцитов и участвует в избегании опухолями иммунитета [12], что делает его мишенью для противоракового лечения.
2.2.3. Fibroblast Growth Factor Receptors (FGFRs)
Фактор роста фибробластов и его рецепторы регулируют различные функции, такие как миграция, пролиферация и дифференцировка широкого спектра типов клеток в здоровых тканях [13]. На основных этапах опухолевой прогрессии, таких как ангиогенез, инвазия и метастазирование новообразований половых клеток [14], рака молочной железы [15] и рака мочевого пузыря [16], сигнал FGF/FGFR является чрезмерным, что позволяет предположить, что он является потенциальной противораковой мишенью. В США в последние годы были одобрены два ингибитора FGFR, Erdafitinib [17] и Pemigatinib [18], для лечения метастатической уротелиальной карциномы и неоперабельной холангиокарциномы, соответственно.
2.2.4. Nutrition-Related Receptors
Быстрая пролиферация опухолевых клеток часто требует избытка питательных веществ, включая альбумин, фолиевую кислоту и железо. Интернализация альбумина основана на связывании с высоким сродством с рецептором gp60 на поверхности эндотелиальных клеток опухоли, а избыточная экспрессия секретируемого белка, богатого цистеином (SPARC) в различных типах опухолей также привлекает альбумин, способствуя накоплению альбумина внутри опухолевых клеток [19]. Рецепторы фолиевой кислоты экспрессируются в агрессивных раковых опухолях, включая рак яичников, рак молочной железы и аденокарциному матки, больше, чем в клетках нормальной ткани [20-23]. Чтобы удовлетворить потребности опухолевых клеток в железе, рецепторы трансферрина часто экспрессируются в 10 раз больше, чем в нормальных тканях [24]. Альбумин и трансферрин могут быть использованы в качестве лигандов для адресной доставки лекарств с хорошей биосовместимостью. Кроме того, трансферрин является потенциальным лигандом, который позволяет наночастицам пересекать гематоэнцефалический барьер (BBB) и нацеливаться на клетки глиомы [25]. При прогрессировании аденокарциномы протоков поджелудочной железы (PDAC) с раком ассоциированные фибробласты (CAFs), которые опосредуют около-опухолевый фиброз и создание лекарственного физического барьера, в значительной степени зависят от SLC7A11 для поглощения цистина и синтеза глутатиона; соответствующие эксперименты показали, что лечение наногенами против SLC7A11 подавляло рост и метастазирование PDAC, активацию CAFs и фиброз [26].
2.2.5. Tumor Specific Antigen, Protein and Peptide Receptor
Специфический состав аминокислотных последовательностей на поверхности опухоли, включая несколько рецепторов, описанных выше, может распознаваться В-лимфоцитами, и они затем стимулируют В-клетки к выработке моноклональных антител с высокой аффинностью к опухолям. В клинических условиях Perjeta и Herceptin, нацеленные на HER2, широко используются при раке молочной железы с избыточной экспрессией HER2 и при аденокарциноме желудка и давали отличные клинические результаты [27]. Наночастицы, связывающиеся с моноклональными антителами, могут эффективно воздействовать на опухоли.
3. Inorganic Nanoparticles
Во многих исследованиях сообщалось о роли и потенциале неорганических наночастиц в онкологии; этот класс NPs обычно обладает уникальными физическими характеристиками, такими как уникальные оптические, электрические, тепловые и магнитные свойства, что обуславливает их широкое применение в диагностике и лечении опухолей. Среди них наночастицы Au и углеродные наночастицы являются наиболее изученными наночастицами.
3.1. Au Nanoparticles
Как один из самых стабильных и наименее токсичных металлических NPs, Au NPs широко используются в качестве системы доставки лекарств, нацеленных на рак. D-P-HGNPs/21 - это последовательная система доставки лекарств, которая проникает в опухолевые клетки через эндоцитарный путь и сначала высвобождает MiR-21i, когда достигает опухоли. Близкое инфракрасное излучение вызывает разрушение полых Au NPs для достижения высвобождения Dox. Более того, два различных эксперимента на клетках рака молочной железы показали, что система последовательного высвобождения D-P-HGNPs/21 оказывает более эффективное ингибирующее действие на рост опухоли [28]. В качестве носителя доксорубицина (Dox) Au NPs, соединенные с простат-специфическим мембранным антигеном (PSMA), могут специфически связываться с клетками рака простаты, избыточно экспрессирующими антиген PSMA. Dongkyu Kim et al. соединили Au NPs, Dox и PSMA-аптамер вместе, а затем наблюдали, что собранный комплекс Au NPs был значительно более мощным против целевых клеток LNCaP, которые избыточно экспрессировали PSMA-антиген, чем против нецелевых клеток PC3, которые не экспрессировали PSMA [29]. Daiki et al. провели аналогичное исследование в 2021 году, подтвердив способность нацеливания на клетки LNCaP этого собранного комплекса Au NPs [30], и был сделан вывод, что PSMA-аптамер, связывающий Au NPs с адриамицином, может убивать раковые клетки LNCaP более эффективно, чем клетки PC3, не являющиеся мишенью [29]. Кроме того, Au-NPs-опосредованная генотерапия может значительно способствовать улучшению противораковой терапии, а использование композиций Au NP для эффективной доставки RNAi для глушения протоонкогенов является перспективной стратегией лечения опухолей [31]. Эксперименты Конде и др. на моделях клеток человека in vitro и позвоночных доказали, что эта стратегия может заставить замолчать протоонкоген c-myc [32]. Хотя существует множество преимуществ генотерапии, доставки лекарств и фото-термического триггерного высвобождения на основе золотых наночастиц, результаты требуют дальнейшего анализа и исследований для получения практических результатов [31]. Наночастицы золота, покрытые белком, также привлекли внимание людей благодаря своей превосходной биосовместимости. AuNPs, покрытые лизоцимом, синтезированные методом химического восстановления, и AuNPs, покрытые коллагеном, синтезированные методом химического восстановления, были эффективно интернализованы клетками остеосаркомы MG-63; таким образом, эти две эффективно поглощаемые наночастицы с покрытием могут быть использованы в качестве диагностических и терапевтических агентов для остеосаркомы [33].
Кроме того, многие исследования показали, что фото-термический эффект наночастиц Au (Au NPs) и их композитных наночастиц является перспективным в клиническом применении для терапии опухолей [34]. Au NPs обладают эффектом поверхностного плазмонного резонанса (SPR), высокой биосовместимостью и стабильностью in vivo; Au NPs также являются идеальными материалами для фото-термического преобразования для увеличения оптического поглощения напрямую [35]. Инфракрасные лучи и лазерное облучение области опухоли in vitro могут непосредственно убивать опухолевые клетки, вызывая локальное сильное нагревание за счет накопления в опухоли photothermal conversion agents (PTAs), таких как Au NPs [36]. Это было названо фото-термической терапией (PTT); PTT вызывает меньшее повреждение нормальных тканей из-за того, что раковые клетки более нетерпимы к теплу по сравнению с нормальными клетками [37]. Однако существуют некоторые недостатки, которые ухудшают клинические результаты PTT, такие как недостаточное накопление в опухоли, низкая эффективность фото-термического преобразования и плохая стабильность PTAs [38]. Полидопамин (PDA), покрывающий Au-Ag NPs, улучшает фото-термическую эффективность за счет смещения пика SPR к длине волны 808 нм, которая соответствует наиболее используемому лазеру в фото-термической терапии [39], а покрытие PDA может улучшить биосовместимость, повысить гидрофильность и снизить цитотоксичность [40]. Однако тепловой эффект NPs с покрытием PDA и чрезмерное накопление NPs с покрытием PDA, локализованных в лизосомах и митохондриях, вызывают дисфункцию лизосом и окислительный стресс, что может вызвать аутофагию опухолевых клеток и в определенной степени защитить опухолевые клетки от внешней стимуляции [41,42]. Wang et al. обнаружили, что опухолевые клетки, предварительно обработанные ингибитором аутофагии хлорохином, демонстрируют более высокую смертность, что также является доказательством в пользу этой точки зрения [43]. Хотя аутофагия в определенной степени оказывает опухолезащитное действие, покрытые PDA Au-Ag NPs все еще демонстрируют сильную способность убивать опухолевые клетки. Культивирование in vitro клеток рака мочевого пузыря T24 показало, что PDA-покрытые разветвленные Au-Ag NPs могут вызывать остановку клеточного цикла и апоптоз опухолевых клеток через различные механизмы, а клетки T24, обработанные PDA-покрытыми разветвленными Au-Ag НП, могут вызывать остановку фазы S, что связано со снижением уровня циклина A и повышением уровня p21 [44]. Циклин А - белок, участвующий в инициации и завершении S-фазы репликации ДНК в ядре [45]; p21 ингибирует прогрессию клеточного цикла, подавляя активность циклин-зависимых киназ [46]; следовательно, клетки T24 будут подвергаться S-фазе. Более того, Au-Ag NPs также участвуют в индуцированном внутренними путями апоптозе опухолевых клеток, а семейство BCL2 контролирует проницаемость митохондриальной мембраны [47]; PDA-покрытые разветвленные Au-Ag NPs снижают уровень BCL2, что приводит к деполяризации мембранного потенциала митохондрий (ΔΨm) и последующему высвобождению цитохрома c в цитоплазматический матрикс. Это активирует каспазу-8 и каспазу-3 для запуска апоптоза в клетках T24 [44]. В ксенотрансплантационной мышиной модели, обработанной лазерным облучением после инъекции высокой дозы NPs, рост опухоли был значительно подавлен [44]. После 12 дней PTT морфология клеток сердца, селезенки и печени мышей существенно не изменилась, в то время как опухолевые клетки показали значительный ядерный лизис, что свидетельствует о низкой токсичности Au NPs для нормальных клеток и специфической высокой токсичности для раковых клеток [44]. Кроме того, накопление в митохондриях покрытых PDA Au-Ag NPs в клеточных моделях рака щитовидной железы in vitro приводило к ингибированию экспрессии дигидрооротатдегидрогеназы (DHODH), за которым следовало усиление транскрипционной активности гена p53, и это вызывало остановку S-фазы опухолевых клеток [48]. На рисунке 2 ниже показаны механизмы остановки цикла пролиферации опухоли и апоптоза, индуцированные PDA-покрытыми Au-Ag NPs при лазерном облучении. Аналогично, pH-чувствительные AuNPs (CytC/ssDNA-AuNP), путем введения смешанного слоя одноцепочечной ДНК и цитохрома c, образуют кластеры частиц в кислой среде и, таким образом, имеют низкую pH-специфическую высокую фототермическую эффективность при близком инфракрасном излучении [49]. Эти pH-реактивные AuNPs могут быть использованы для таргетной терапии рака и повысить эффективность их фототермического преобразования в PTT на основе кислой микросреды опухоли [50]. Более того, механизм поведения pH-реакции, основанный на электростатических взаимодействиях между частицами, позволяет обратимо агрегировать или разбирать кластеры частиц в зависимости от pH раствора, предполагая, что CytC/ssDNA-AuNPs имеют потенциал для многократного терапевтического воздействия на поражения [49].
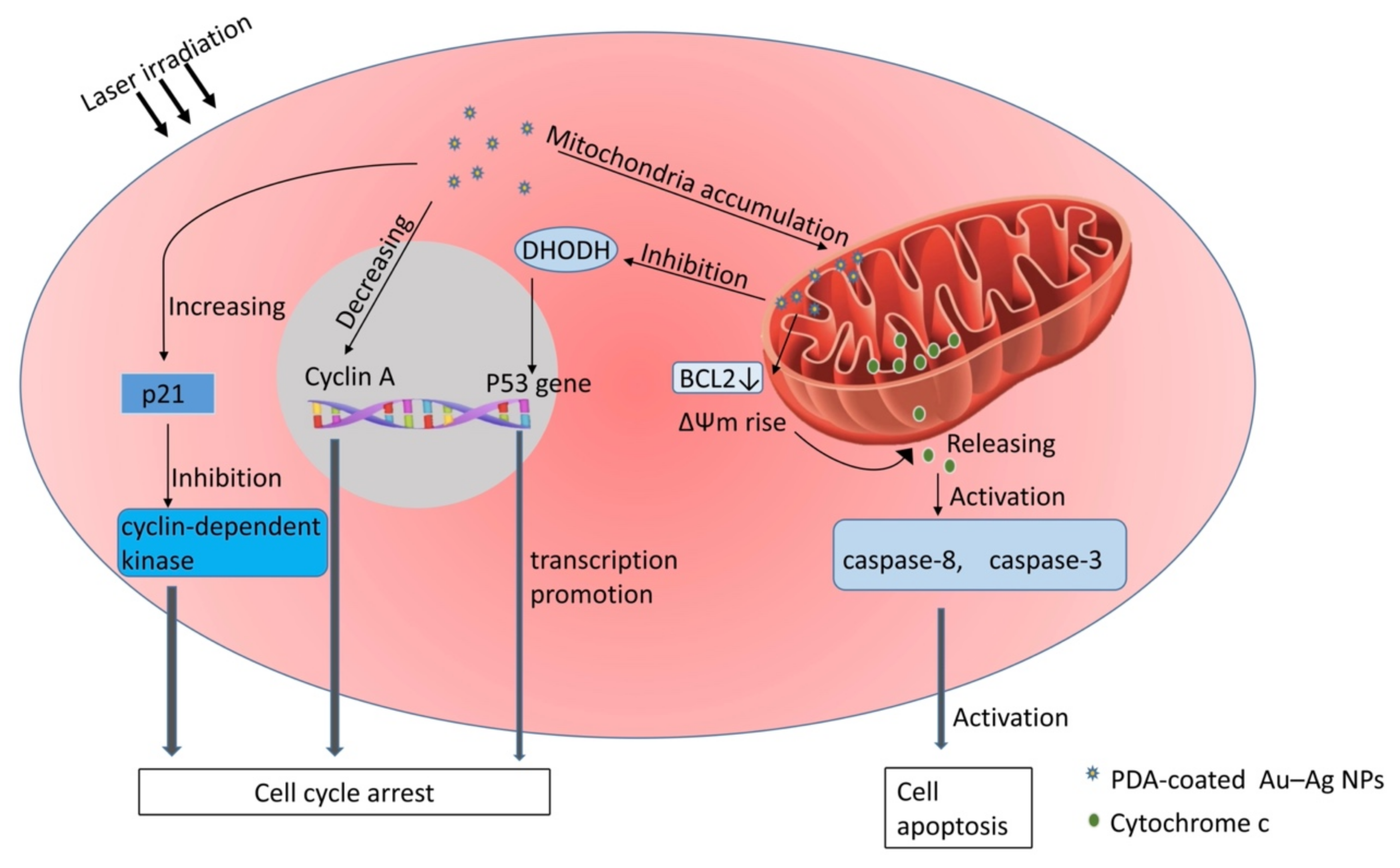 Figure 2. Mechanism of laser-irradiation-induced proliferation arrest and apoptosis of PDA-coated-Au-Ag-NP-treated tumor cells. In tumor cells, PDA-coated Au-Ag NPs increase the p21 level, which inhibits the activity of cyclin-dependent kinases, and decrease the Cyclin A level, which plays an important role in the initiation and termination of S-phase DNA replication at the nuclear. In addition, the mitochondrial accumulation of PDA-coated Au-Ag NPs leads to the inhibition of DHODH expression, followed by enhanced transcriptional activity of p53 gene, an important tumor-suppressor gene. All of these together will result in the S-phase arrest of tumor cells. The BCL2 family controls the permeability of mitochondrial membrane. PDA-coated branched Au-Ag NPs induced the decrease of BCL2 level, which further led to the depolarization of mitochondrial membrane potential (ΔΨm) and the subsequent release of cytochrome c into the cytoplasmic matrix; this activates caspase-8 and caspase-3, which then trigger cell apoptosis.
3.2. Carbon Nanoparticles
Углерод имеет множество наноаллотропных форм, включая фуллерены, нанотрубки и нано-алмазы. Их богатые формы открывают широкие возможности для распознавания опухолей, лечения и доставки лекарств [51]. Однако гидрофобность углеродных наночастиц ограничивает их применение в медицине. Эта проблема может быть в определенной степени решена путем модификации гидрофильных групп на поверхности углеродных наночастиц, при этом токсичность углеродных наночастиц может быть одновременно снижена [52,53]. Paclitaxel (PTX) является широко используемым химиотерапевтическим препаратом для лечения рака молочной железы, на эффект которого влияет плохая растворимость в воде; таким образом, альбумин-связанный PTX является обычной лекарственной формой в клинике для улучшения его растворимости в воде [54]. Shao et al. [55] обнаружили, что когда сывороточный альбумин человека (HSA), модифицированный одностенными углеродными нанотрубками (SWCNT), а именно комплекс SWCNT-HSA, используется в качестве носителя для доставки PTX, скорость поглощения клетками рака молочной железы MCF-7 может достигать 80%, и этот комплекс проявляет более сильный противоопухолевый эффект, чем модифицированный PTX. Алмазные нано-частицы (NDs) обладают высокой биосовместимостью и низкой токсичностью для нормальных клеток; они также могут образовывать комплексы с плохо растворимыми в воде химиотерапевтическими агентами [56]. Существование BBB является огромным препятствием в лечении злокачественных опухолей мозга [57]. Liang et al. предложили NDs, меченные PEGylated денатурированным бычьим сывороточным альбумином (BSA), и трипептиды RGD, нацеленные на опухолевую сосудистую сеть, которые являются dcBSA-PEG-NDs, и показали высокую эффективность в селективном нацеливании на опухолевые участки у мышей, несущих U-87 MG, через BBB [58]; модели BBB in vitro показали, что в этом процессе участвуют механизм трансцитоза и дополнительный прямой межклеточный транспорт через туннельные нанотрубки [59]. Одним из способов подавления дефектных генов является доставка интерферирующей РНК (siRNA) в опухолевые клетки. Однако нестабильность siRNA и низкое поглощение опухолевыми клетками ограничивают её применение, но эксперименты in vitro с клетками рака молочной железы MCF-7 показали, что модифицированные NDs могут быть созданы в комплекс с siRNA для более эффективной доставки siRNA в опухолевые клетки и глушения экспрессии дефектных генов [60].
Другим применением углеродных наноматериалов является идентификация опухолевых и нормальных тканей во время операции, а также лимфатических узлов, оттекающих от опухолевых областей. Рак щитовидной железы является наиболее распространенным эндокринным злокачественным заболеванием, частота которого резко возросла в последние десятилетия, а папиллярный рак щитовидной железы является основной причиной, поскольку на него приходится от 85% до 90% всех случаев рака щитовидной железы [61]. По данным с 1994 по 2013 год, не менее 28,6% из них имели опухоли диаметром 1 см и менее, которые называются папиллярными микрокарциномами щитовидной железы (PTMCs) [62]. Стандартной хирургической процедурой при PTMCs является тотальная тиреоидэктомия и соответствующая диссекция лимфатических узлов; основными рисками этой операции являются повреждение паращитовидных желез и повреждение возвратного гортанного нерва [63]. Углеродные наноматериалы диаметром 150 нм попадают в лимфатические сосуды и затем транспортируются в региональные лимфатические узлы, но не попадают в кровеносные сосуды [64]. Внутриопухолевое введение углеродных наноматериалов для окрашивания тканей опухоли и регионарных лимфатических узлов для защиты тканей паращитовидной железы широко используется [65]. Однако последние исследования показали, что внутри-опухолевое введение углеродных наноматериалов не может снизить частоту развития гипопаратиреоза, и это может быть связано с тем, что паращитовидные железы обладают компенсаторным потенциалом [64]. Для пациентов с раком эндометрия низкого риска клинические испытания подтвердили, что цервикальное введение углеродных наночастиц в сочетании с индоцианином зеленым может значительно улучшить частоту обнаружения меченных лимфатических узлов (SLN) [66]. У пациентов, подвергшихся лапароскопической радикальной операции по поводу рака желудка, те, кто получил маркировку углеродными наноматериалами, могут увеличить частоту обнаружения лимфатических узлов на 25,7% и сократить время операции на 15,3% по сравнению с контрольной группой [67]. PTMCs считаются раком низкого риска. Термическая абляция (ТА), как один из наиболее привлекательных методов, достигла большого успеха при многих злокачественных заболеваниях, включая рак печени и рак почки. В последние годы эта технология постепенно внедряется в лечение PTMCs и даже PTCs [68], эффект микроволновой абляции был удовлетворительным, а показатель уменьшения объема опухоли (VRR) достиг или даже превысил 99% [69]. По сравнению с традиционными открытыми хирургическими методами, частота осложнений относительно низкая, а разница между показателями рецидивов не была статистически значимой [69]. Однако микроволновая абляция все же имеет определенный риск повреждения окружающих тканей. Эксперименты на мышах с ксенотрансплантацией рака щитовидной железы TPC-1 показали, что внутри-опухолевое введение углеродных наноматериалов может поглощать свет в ближней инфракрасной области, преобразовывать свет в тепло и достигать температуры 50-56 °C в опухоли; этого достаточно для уничтожения опухолевых клеток, что позволяет избежать системной токсичности и защитить паращитовидную железу, поскольку углеродные наноматериалы действуют только на опухолевую ткань [70]. Это говорит о том, что применение фото-термического эффекта углеродных наноматериалов при раке щитовидной железы является перспективным направлением в будущем.
3.3. Lipid-Based Nanoparticles
Нано-биоматериалы на основе липидов, наиболее широко изученные системы доставки противораковых препаратов, представляют собой везикулярные структуры, состоящие из одного липидного бислоя, который заключает противораковый препарат в гидрофильное ядро [71]. Нанобиоматериалы на основе липидов в основном включают липосомы, нано-эмульсии, липидные наночастицы (LNPs) и твердые липидные наночастицы (SLNs), которые обладают многими преимуществами, такими как простота изготовления, способность к самосборке в водной среде, повышенная биодоступность, биосовместимость, биоразлагаемость основных компонентов, низкая токсичность и способность переносить гидрофильные и гидрофобные соединения [72]. Кроме того, основные проблемы, с которыми сталкивается этот тип систем доставки лекарств, - как повысить их стабильность, как увеличить время пребывания в циркуляции и как повысить эффективность доставки лекарства или молекул нуклеиновой кислоты к клеткам-мишеням [73]. PEGylated липосомы, или долго циркулирующие (stealth) липосомы, представляют собой липосомы, модифицированные и функционализированные гидрофильными полимерными цепями, включая полиэтиленгликоль (PEG), полиэтиленоксид (PEO), полоксамер, полоксамин, полисорбат (Tween-80) и лауриловый эфир (Brij-35); это может эффективно увеличить время их пребывания в циркуляции [74]. Системы доставки лекарств на основе липидов функционируют двумя способами: Один способ - активное нацеливание, как описано ранее, путем нацеливания на определенные участки, соединяя липосомы с лигандами, которые могут связываться со специфическими рецепторами клеток-мишеней [75]. Другой способ - пассивное нацеливание, которое реализуется через эффект EPR [73]. Различные схемы могут быть разработаны для изменения среднего нанометрового размера, однородности, поверхностного потенциала, загрузки лекарства и типа лиганда наночастиц на основе липидов для повышения эффективности доставки лекарства в клетки-мишени [76,77]. Исследования последних десятилетий позволили использовать различные липосомные формулы в биомедицинских целях или клинических испытаниях после преодоления вышеупомянутых недостатков, как показано в таблице 1 ниже.
Table 1. Current lipid nanoparticles for cancer treatment and drug regimens being studied in clinical trials. Date from ClinicalTrails.gov.
3.3.1. Advances in Multifunctional Lipid-Based Nanobiomaterials
Липосомы широко используются для объединения различных терапевтических классов противораковых препаратов для химиотерапии и иммунотерапии, генной терапии, фотохимиотерапии и т.д. Липосомный доксорубицин (Doxil) - первая терапевтическая наночастица, получившая клиническое одобрение для лечения рака с использованием PEGylated липосом, заложившая основу для интенсивных исследований в области нанотехнологий для лекарств, направленных на опухоли [78]. Более того, впоследствии многие липосомные составы для доставки противораковых препаратов успешно прошли клинические испытания.
3.3.2. New Therapeutic Techniques Involving Lipid-Based Nanobiomaterials
В последнее время внимание было привлечено к изучению природных липосом. Экзосомы, как мембранные везикулы диаметром 30-100 нм, имеют двойную липидную мембрану с тем же путем происхождения, что и плазматическая мембрана, содержат внутри себя белки и генетический материал, играющие важную роль в межклеточной коммуникации [79]. Благодаря присущим им отличным свойствам, включая широкое распространение в биологических жидкостях, присущую им способность к самонаведению и способность проникать через BBB, экзосомы, несомненно, могут быть идеальными носителями для доставки лекарств [80]. Например, экзосомы, выделенные из MSCs, могут быть использованы в качестве нано-носителей лекарств для загрузки paclitaxel (PTX) при лечении рака поджелудочной железы [81]; экзосомы, выделенные из незрелых дендритных клеток мыши (imDC), могут быть использованы для загрузки доксорубицина (Dox) при лечении рака молочной железы [82].
Кроме того, были предприняты попытки объединить несколько нано-носителей таким образом, чтобы преодолеть их соответствующие недостатки без ущерба для их первоначальных свойств. Системы Lipid-polymer hybrid nanoparticle (LPHNP) могут стать надежным подиумом для доставки лекарств с высокой эффективностью инкапсуляции, определенной кинетикой высвобождения, с отличной переносимой стабильностью в сыворотке крови и хорошо выраженными тканевыми, клеточными и молекулярно-таргетными свойствами [83]. В 2010 году Wang et al. предложили LPHNPs для моделей рака простаты, названную ChemoRad NPs, предназначенную для совместной доставки химиотерапевтических препаратов и терапевтических радиоизотопов; Эта платформа состоит в основном из двух частей, полимерного ядра из полилактид-когликолевой кислоты (PLGA), которое инкапсулирует химиотерапевтический агент (доцетаксел), и липидного хелаторного слоя DMPE-DTPA, который хелатирует радиотерапевтический агент (индий-111 или иттрий-90); они продемонстрировали лучшую способность доставки и более высокую терапевтическую эффективность NPs ChemoRad [84]. В 2013 году Zheng et al. успешно синтезировали гибридные NPs, содержащие PLGA-лецитин-PEG, которые подавляют рост чувствительных к DOX клеток MCF-7 и устойчивых к DOX клеток MCF-7/ADR посредством доксорубицина (DOX) и индоцианина зеленого (ICG), загруженных в наночастицы PLGA-лецитин-PEG (DINPs); эти липидно-полимерные наночастицы, нагруженные DOX/ICG, демонстрируют более быстрое высвобождение DOX, более длительное время удержания в опухолях и улучшенное хемо-фото-термическое поведение при лазерном облучении [85].
3.4. Polymeric Nanoparticles
Полимерные наночастицы (PMs) - это частицы размером 10-1000 нм, образованные амфифильными блок-сополимерами, состоящими из гидрофильных и гидрофобных полимерных цепей, соединенных ковалентными связями [86]. PMs спонтанно образуются в результате самосборки блок-сополимеров при помещении в водную среду [86]. Более того, противораковые препараты могут быть загружены в полимерное ядро или адсорбированы на поверхности полимерной оболочки [87]. Нанокапсулы - это капсульные системы, в которых лекарство находится в полости, окруженной уникальной полимерной мембраной, а нано-сферы - это матричные системы, в которых лекарство физически и равномерно диспергировано в матрице [86,88]. Биосовместимость, биодеградируемость и нетоксичность являются основными характеристиками полимерных NPs. Согласно отчету Maurya et al., использование полимерных NPs является безопасным для человека [86]. Преимущества полимерных NPs в качестве носителей лекарств заключаются в том, что они могут контролировать скорость высвобождения лекарства, защищать лекарства и другие биологически активные молекулы от воздействия окружающей среды, а также улучшать биодоступность и терапевтический индекс лекарства [87].
При использовании полимерных наночастиц в качестве носителей противораковых препаратов, они обычно не разрушаются фагоцитами в кровообращении, но происходит секвестрация в органах, обогащенных PMs. Если полимерные наночастицы не являются биодеградируемыми, частицы будут накапливаться в этих органах, чаще всего в печени и селезенке, что в конечном итоге приведет к токсичности и другим негативным побочным эффектам [89].
Hadia et al. успешно разработали полимерную наночастицу хитозана с инкапсулирующими доцетаксел циклодекстринами методом ионного гелеобразования; они обнаружили, что эта полимерная наночастица DTX CDs/CS демонстрирует значительные преимущества в высвобождении лекарства по сравнению с чистым препаратом [90]. Кроме того, они оценили безопасность PMs путем перорального введения CD кроликам. Они обнаружили, что сульфобутиловый β -циклодекстрин (BE7-β-CD) и другие виды CD остаются неповрежденными и практически не всасываются в желудочно-кишечном тракте; CD, которые попадают в кровообращение, выводятся только почками [90]. Они показали минимальную обратимую токсичность для почек, печени и легких, которая зависит от дозы и продолжительности приема [90]. Еще одним недавно изученным PMs является полимерная наночастица L-глутаминовой кислоты-g-p (HEMA); в исследовании, проведенном в 2020 году, использовалась линия клеток эпителия бронхов человека (16 HBE) и линия моноцитарных клеток человека (THP-1), культивируемых in vitro, для проведения теста миграции клеток для исследования заживления ран. Они наблюдали 21% разницу в процентном закрытии между контрольной и экспозиционной группами через 2 часа; это указывает на то, что пролиферация и миграция клеток, подвергшихся воздействию, была медленнее, чем у контрольных клеток [91]. Хотя некоторые исследования предположили, что амины в поли-L-глутаминовой кислоте в наночастицах могут влиять на токсичность, что может вызывать гемолиз [92,93], они не обнаружили никакого влияния HEMA на эритроциты из образцов свежей крови кролика [91]. Тест на курином яйце/хориоаллантоидной мембране является стандартным тестом in vitro для изучения раздражения глаз при альтернативных испытаниях на животных [94], при внутривенном введении HEMA не были обнаружены кровотечения, лизис сосудов или эффекты коагуляции, это указывает на то, что наночастицы на основе HEMA являются безопасной системой доставки лекарств в глазах [91]. Однако, из-за ограничений методов исследования, их эксперименты не смогли достоверно и полно оценить токсичность HEMA in vivo. Поли-алкил цианоакрилат (PACA) обладает хорошей биоразлагаемостью и высокой загрузочной способностью, что делает его перспективным носителем лекарств [95]. Einar et al. отметили, что PACA обладает определенной цитотоксичностью, которая была связана со скоростью деградации. PBCA, PEBCA и POCA - это три типа PACA. НП PEBCA с промежуточной скоростью деградации были значительно менее токсичны, чем НП PBCA и POCA (быстрая и медленная скорость деградации). Этот токсический эффект может быть связан с агрегацией и пери-нуклеарной локализацией внутриклеточных лизосом, индуцированной PACA [96]. В таблице 2 мы обобщили результаты исследований токсичности различных полимерных наночастиц. Однако для выяснения истинного метаболического процесса и токсичности полимеров in vivo необходимы более обширные исследования. В целом, согласно имеющимся данным, представленным в таблице 2, где обобщены исследования по токсичности различных полимерных наночастиц, наночастицы на основе полимеров обладают хорошей биосовместимостью и низкой токсичностью, что открывает широкие перспективы для направленного транспорта лекарств.
Table 2. Experimental studies on toxicity of polymeric nanoparticles.
3.4.1. Functionalization of Polymeric Nanoparticles
Полимеризационная модификация PMs химическими методами является наиболее распространенным методом функционализации. Некоторые примеры экранирующих групп, участвующих в химической модификации, включают полисахариды, полиакриламид, поли (виниловый спирт), поли (N-винил-2-пирролидон), PEG и сополимеры, содержащие PEG, такие как полиоксамин, полиоксамин, полисорбит и сополимеры PEG [97]. Из всех полимеров, испытанных до настоящего времени, PEG и сополимеры, содержащие PEG, являются наиболее эффективным и широко используемым методом [97]. Эти полимеры обычно обладают высокой гидрофильностью и нейтральным зарядом, и они могут помочь защитить даже гидрофобные или заряженные частицы белков крови [89].
Shi et al. создали смешанные мицеллы FA-PEG/PEO-PPO-PCL, нагруженные DTX, для повышения специфичности DTX и улучшения противораковой эффективности [98]. Palanikumar et al. разработали pH-чувствительные гибридные ATRAM-BSA-PLGA NPs, которые состоят из сшитой оболочки бычьего сывороточного альбумина и инкапсулированного ядра PLGA, а оболочка функционализирована пептидом ATRAM (acid triggered rational membrane) [99]. Смешанные полимерные мицеллы имеют идеальный размер, низкое значение CMC и незначительную гемолитическую активность, что, соответственно, обеспечивает их хорошее накопление в опухолевой ткани, высокую стабильность циркуляции и хорошую биосовместимость [100,101].
На сегодняшний день PEGylation все еще является эталоном для разработки функциональных нано-носителей в системах доставки лекарств. Тем не менее, интересно отметить, что во многих отчетах указывается, что наночастицы PEGs могут вызывать неожиданные иммуногенные реакции, которые приводят к "феномену ускоренного клиренса крови (ABC)" и реакциям гиперчувствительности (HSRs) [102]. Конкретный механизм показан на рисунке 3 ниже. После многократного введения PEGylated липосом крысам, увеличение печеночного накопления при введении второй дозы указывает на важную роль печени в ускоренной очистке [103]. Между тем, этот феномен ускоренного клиренса наблюдается и у нормальных крыс, которым переливают сыворотку крысы, обработанную инъекцией PEGylated липосом [104], поэтому клеточный иммунитет (клетки Купфера) и гуморальный иммунитет работают вместе, приводя к этому феномену ABC [103,104]. Этот недостаток PEGylation привлек большое внимание, поскольку он создает потенциальные проблемы в клинической работе, снижая терапевтический эффект инкапсулированных препаратов после повторного введения [102]. После первой инъекции PEGylated липосом они связываются с В-клетками в маргинальной зоне селезенки, вызывая выработку анти-PEG IgM антител независимым от Т-клеток образом [105]; это усиливает поглощение PEGylated липосом печеночными клетками Купфера при введении второй дозы PEGylated липосом, что приводит к увеличению скорости очистки [106,107]. Структура носителя может влиять на феномен ABC. Xu et al. модифицировали липосомы расщепляемыми производными PEG-липидов (PEG-CHEMS и PEG-CHMC), и было вызвано лишь незначительное явление АВС [108]. Аналогично, gadolinium содержащие полимерные мицеллы на основе PEG-поли(L-лизина) не вызывали феномена ABC, в то время как PEGylated липосома вызывала сильный феномен ABC [109]. Maitani et al. отметили, что гидрофобное ядро мицеллы или липидный бислой PEGylated липосомы играют важную роль в этом явлении [109]. Лекарство, инкапсулированное в носитель, кажется важным фактором, который может влиять на явление ABC. При клиническом применении повторное введение PEGylated липосомального доксорубицина снижает его клиренс; одно исследование объясняет это токсической активностью доксорубицина на печеночную и селезеночную ретикулоэндотелиальную систему [110]. Ishida et al. доказали, что инкапсулированный доксорубицин снижает выработку анти-PEG IgM путем вмешательства в пролиферацию В-клеток и последующего снижения иммунного ответа против PEG-липосом [111]. Это можно проверить при повторных инъекциях PEGylated липосомальных топотеканов крысам, которые вызывают сильный феномен ABC [112], поскольку, будучи препаратом, специфичным для фазы клеточного цикла, топотекан может ингибировать только часть В-лимфо-лейкоцитов, находящихся в S-фазе клеточного цикла [112]. Введение нано-носителей, содержащих PEG, может взаимодействовать с иммунной системой и приводить к нежелательным HSRs, также известным как псевдо-аллергия, связанная с С-активацией (CARPA) [113]. Хотя точный механизм PEG-индуцированных CARPA до конца не выяснен, появляется все больше доказательств того, что активация комплемента играет определенную роль в этом процессе [114,115]. Система комплемента высвобождает C3a и C5a, которые приводят к активации воспалительных клеток, таких как макрофаги, базофилы и тучные клетки, и способствуют возникновению HSRs [114,115,116]. Последние исследования подчеркивают важную роль анти-PEG антител в PEG-индуцированном классическом пути CARPA, по крайней мере, в случае Pegfilgrastim (PEG-G-CSF) и PEGylated липосом [117,118]. Было предложено использование других альтернативных химических групп, таких как PDX [119], биоразлагаемые полимеры на основе поли(аминокислот) [120] и поликапролактон, содержащий сульфобетаин [121], но лучшей стратегией является минимизация иммуногенности PEGs; использование все более разветвленных PEGs (например, гиперразветвленных, звездчатых, дендритных и бутылочных) с меньшей молекулярной массой на ветви могут уменьшить распознавание антителами, специфичными для ветви, сохраняя при этом преимущества PEGs [122]. По сравнению с метокси (OCH3), которая является обычной терминальной группой полимеров, используемых в клинических приложениях, гидроксил PEG-модифицированные липосомы (PL-OH) эффективно снижали анти-PEG IgM ответ in vitro [123]. Другие попытки модификации терминальных групп полимеров включают цвиттерионные, этокси- и n-бутиловый эфир [124,125]. Ханна и др. сообщили, что предварительная обработка микофенолатом мофетилом, иммунодепрессантом B/T-клеток, значительно улучшила результаты лечения в исследовании I фазы среди пациентов с подагрой, получавших pegloticase; это позволяет предположить, что предварительная обработка или конъюгация с иммунодепрессантом может снизить иммуногенность полимера [126]. Необходимо срочно провести дальнейшие исследования для улучшения нашего слабого механистического понимания иммуногенности, вызванной полимерами, и связанных с ней краткосрочных и долгосрочных рисков для здоровья.
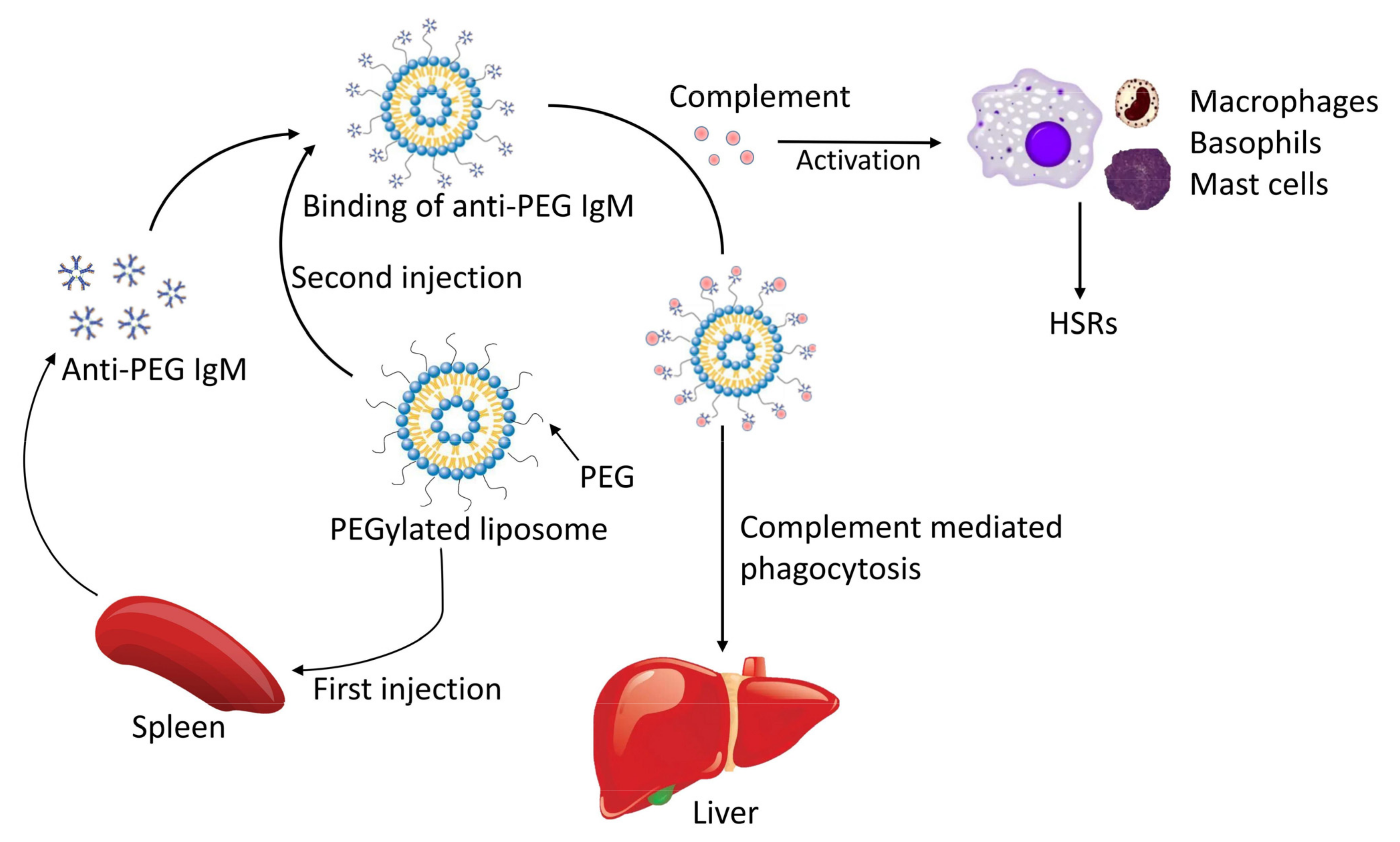 Figure 3. The mechanism of ABC phenomenon and HSRs induced by PEGylated liposomes for its immunogenicity.
По сравнению с другими наноматериалами, полилактид (PLA) и полилактид-когликолевая кислота (PLGA) являются наиболее перспективными полимерными кандидатами для систем доставки лекарств, поскольку они обладают низкой токсичностью и биоразлагаемы, демонстрируя хорошую биосовместимость [127]. Контролируя размер, форму, молекулярную массу и соотношение L:G, PLA и PLGA могут получить идеальные фармакокинетические характеристики [128,129]. PLA также может быть собран как гидрофобный блок с другими полимерами, такими как PEG, для получения амфифильных блок-сополимеров [100]. В системе доставки лекарств свойством "stealth" обладает гидрофильная корона мицелл амфифильного сополимера, что уменьшает их поглощение ретикулоэндотелиальной системой; это продлевает время жизни загруженного лекарства в крови, улучшая биодоступность [130]. В одном исследовании созданные композиты оксид графена/PLA-PEG показали удовлетворительную нагрузочную способность паклитаксела и эффективность высвобождения лекарства, и этот комплекс мог проникать в модель клеток рака легких A549 in vitro и демонстрировал хорошую цитотоксичность [131]. Наночастицы на основе PLA демонстрируют особые преимущества в отношении альтернативных путей введения (например, перорального, легочного и мукозального), а также длительную эффективность доставки генов [132,133]. В мышиной ксенотрансплантационной модели MDA-MB-435s (раковые клетки) малый интерферирующий polo-like киназа 1 (siPlk1), доставленный наночастицами PEG-PLA, показал хорошие результаты, значительно подавив рост опухоли [134]. Применение инкапсулированного в B6-NP нейропротекторного пептида NAPVSIPQ (NAP) в мышиной модели болезни Альцгеймера может привести к превосходному улучшению состояния даже при низких дозах [135]. Это исследование показывает, что модифицированный пептидом B6 NPs могут преодолевать гематоэнцефалический барьер и имеют потенциальные возможности применения в системе целевой доставки лекарств для лечения опухолей мозга [135]. Кроме того, lv. et al. сообщили о новом нано-композите из нано-волокон полилактида (PLA) и магнитных наночастиц Fe3O4, покрытых тетрагептиламмонием; они подтвердили, что этот нано-композит может эффективно облегчить взаимодействие даунорубицина с лейкозными клетками и значительно улучшить проницаемость и поглощение противораковых препаратов в раковых клетках [136]. Все большее функционализирование мицелл и наночастиц амфифильного сополимера на основе PLA позволяет удовлетворить основные требования к доставке лекарств, включая скрытность, контролируемое высвобождение лекарств и целевые свойства. Однако бесконечно появляются новые наночастицы на основе PLA, модифицированные или соединенные с другими полимерами, а также другие типы наночастиц; их эффективность и безопасность в клинических условиях еще предстоит проверить.
3.4.2. Clinical Application of Polymeric Nanoparticles
PMs и их функционализация были широко изучены для лечения различных типов опухолей благодаря их взаимодействию с хорошо известной и изученной опухолевой микросредой. Среди различных мицеллярных составов, PMs PTX доказали свою хорошую клиническую эффективность при лечении поздних стадий рака легких [137], рака молочной железы [138], рака центральной нервной системы [139] и оофоромы [140]. Zhou et al. использовали метод твердофазного синтеза для создания циркулирующей нано-липосомы с паклитакселом, нацеленной на рак легких, и провели эксперименты с несущими опухоли мышами nude [137]. Они обнаружили, что это может повысить безопасность введения паклитаксела и противоопухолевую эффективность за счет улучшения тканевого распределения паклитаксела в организме [137]. Shi et al. ввели этоксиполиэтиленгликоль фолиевой кислоты (FA-PEG) в мицеллы, нагруженные DTX, в качестве эффективной таргетной части приготовленных мицелл FA-PEG/PEO-PPO-PCL [98]. Эксперименты показали, что он обладает отличной способностью к самосборке в воде и высокой устойчивостью к разбавлению при циркуляции [98]. Кроме того, результаты цитотоксичности in vitro показали, что мицеллы FA-PEG/PEO-PPO-PCL обладают более высокой цитотоксичностью в отношении FR-положительных клеток MCF-7, чем мицеллы PEO-PPO-PCL [98]. Интересно, что Chen et al. сообщили о своеобразной нано-частице, покрытой мембраной раковой клетки, для адресной доставки доксорубицина и PD-L1 siRNA [141]. Благодаря скрытности клеточной мембраны биомиметические нано-частицы могут быть модифицированы и функционализированы благодаря способности к самораспознаванию и нацеливанию на источник, что сопровождается длительной циркуляцией крови и спасением от иммунного захвата для достижения точной направленной терапии рака [141].
3.5. Protein Nanoparticles
Белки - это существующие в природе биомолекулы, которые считаются идеальными материалами для получения наночастиц благодаря своей безопасности, биосовместимости и биоразлагаемости [142]. Такие наночастицы из природных белков могут метаболизироваться организмом и легко модифицировать поверхность с целью прикрепления противораковых препаратов и связывания лигандов [143]. Белки можно разделить на два типа: животные белки, такие как альбумин, желатин, эластин, молочный и сывороточный белок; и растительные белки, такие как глиадин, соевый и кукурузный белок [144].
3.5.1. Animal Proteins
Хотя термин "альбумин" часто ассоциируется с сывороточным альбумином, он также часто используется для описания семейства белков, характеризующихся растворимостью в воде [145]. В этом семействе сывороточный альбумин и сывороточный белок являются наиболее используемыми белками для приготовления наночастиц для доставки лекарств [146]. Двумя основными представителями группы сывороточного альбумина являются человеческий (HSA) и бычий сывороточный альбумин (BSA). HSA широко используется в качестве безопасного и эффективного белка-носителя в различных системах доставки благодаря тому, что он является более неиммуногенным белком плазмы [146]. На рисунке 4 ниже показаны различные типы носителей на основе альбумина.
![]() Figure 4. Different types of albumin-based carriers.
Альбумин имеет два основных сайта связывания, позволяющих комплексообразование металлов, жирных кислот и лекарств, включая цисплатин, белковые и пептидные препараты [147]. Наличие этих сайтов позволяет функционализировать специфическую доставку терапевтического вещества [148]. Наночастицы на основе альбумина могут быть модифицированы или нагружены целевыми лигандами на поверхности для изменения распределения в организме и улучшения их поглощения клетками; это может в некоторой степени избежать нежелательной токсичности лекарств и улучшить их целевую способность [148,149]. Wu et al. разработали мицеллы сополимера альбумина для доставки доксорубицина; в процессе приготовления гидрофобное взаимодействие между полипептидными каркасами используется для загрузки доксорубицина; по сравнению со свободным DOX, этот носитель демонстрирует более высокую цитотоксичность препарата и более высокую стабильность в зависимости от Ph [150]. В дополнение к лекарствам, белки также могут быть доставлены мицеллами на основе BSA к месту их воздействия. Jiang et al. приготовили поли-ионные комплексные мицеллы на основе BSA для доставки Spry1. Эти мицеллы показали повышенную цитотоксичность в отношении MCF7, которая относится к клеточным линиям рака молочной железы, и продемонстрировали высокую противораковую эффективность, подавляя рост трехмерных многоклеточных опухолевых сфероидов MCF-7 [151]. Кроме того, в последние несколько лет были исследованы различные нано-конъюгаты на основе альбумина, включая конъюгат альбумин-полимер, конъюгат альбумин-лекарство и конъюгат альбумин-металл. Остатки цистеина (Cys) и лизина (Lys) в альбумине являются наиболее изученными местами связывания для получения ковалентно соединенных наноконъюгатов альбумина; в то же время, не-ковалентное взаимодействие между альбумином и конъюгирующим веществом обусловлено гидрофобными и электростатическими взаимодействиями, которые также выступают в качестве движущей силы в образовании конъюгатов альбумина [152]. Поскольку альбумин имеет длительный период полураспада в организме человека, конъюгат альбумин-лекарство продлевает циркуляцию лекарства in vivo, что также может смягчить и преодолеть множественную лекарственную устойчивость противораковых препаратов [153]. Несколько препаратов, включая DOX, цисплатин, доцетаксел и т.д., были использованы для приготовления конъюгатов альбумин-лекарство. Конъюгаты доцетаксел-альбумин были разработаны и проверены Esmaeili et al.; они обладали повышенной растворимостью и способностью нацеливаться на опухоли [154]. Аналогично, конъюгат SN38-HSA демонстрировал лучшую растворимость и стабильность [153]. Хотя система доставки нано-препаратов на основе альбумина имеет большие преимущества, недостатками альбумина являются его ограниченное применение, включая присущие ему целевые группы, не обладающие стабильностью при гидролизе белка, а также ограниченная и низкая применимость к гидрофильным и электрофильным препаратам [155,156]. Однако, конъюгируя альбумин с другим полимером, эти недостатки можно преодолеть. По сравнению с полимер-платиновым конъюгатом без альбуминового покрытия, полимер-платиновый конъюгат с альбуминовым покрытием может значительно увеличить скорость поглощения клетками рака яичников и усилить их клеточную токсичность [157]. Более того, как уже упоминалось ранее, Liang et al. предложили NDs, меченные PEGylated денатурированным бычьим сывороточным альбумином (BSA) и трипептидами RGD, нацеленными на опухолевую сосудистую сеть, то есть dcBSA-PEG-NDs, которые показали высокую эффективность в избирательном нацеливании на опухолевые участки в U-87 MG мышей через BBB [58]. В другом исследовании Liu et al. приготовили DOX-инкапсулированную cetuximab-functionalized BSA-PCL нано-везикул в качестве нано-носителя, нацеленного на опухоль, и наблюдали повышенную противоопухолевую активность [158]. Tang и др. разработали наночастицы с оболочкой из витамина Е (VE)-альбумина для доставки паклитаксела (PTX) с целью улучшения эффекта химиотерапии в моделях рака молочной железы MDR. По сравнению с NPs без VE (PTX NPs), PTX VE NPs значительно увеличивали поглощение PTX клетками, демонстрируя более сильную цитотоксичность и более высокую противораковую эффективность [159]. Shen et al. приготовили систему доставки наночастиц erlotinib, модифицированных гиалуроновой кислотой и сывороточным альбумином человека (ERT-HSA-HA NPs), используя метод преципитации. Исследование in vivo показало, что частицы продемонстрировали превосходный анти-пролиферативный эффект на клетках A549. Что касается противоопухолевой активности in vivo, то у мышей, обработанных ERT-HSA-HA-NPs, наблюдалось значительное подавление роста опухоли и отсутствие рецидивов после 30 дней лечения [160]. В заключение следует отметить, что нано-носители на основе альбумина обладают такими преимуществами, как относительная безопасность и простота приготовления, возможность доставки различных типов молекул и специфическое нацеливание с помощью модификации поверхности. Эти свойства делают альбумин наиболее широко используемым белком для приготовления систем доставки лекарств.
3.5.2. Plant Proteins
По сравнению с животным белком, растительный белок обладает лучшей биосовместимостью и меньшей иммуногенностью [161]. Lee et al. разработали гибридные наночастицы из зеина с хондроитинсульфатом для адресной доставки доцетаксела. По сравнению со свободным доцетакселом, эти NPs обладают улучшенными фармакокинетическими свойствами и значительно более высокой противоопухолевой эффективностью, а вызванная системная токсичность может быть проигнорирована [162]. Gulfam et al. использовали систему электрораспылительного осаждения для синтеза композитных наночастиц глиадина и глиадин-желатина для контроля доставки противораковых препаратов (таких как циклофосфамид) и регулирования скорости их высвобождения, и доказали, что циклофосфамид, загруженный 7% наночастицами глиадина, может заставить в клетки рака молочной железы и вызывать апоптоз через 24 часа [163]. Все больше исследователей обращают внимание на белковые наночастицы; существует также множество статей, сообщающих о ходе исследований различных белковых наночастиц. Однако исследователям все еще необходимо подумать о том, как сделать так, чтобы больше белковых наночастиц применялось в клинической практике, а не только в исследованиях. Кроме того, безопасность и эффективность белковых наночастиц в качестве носителей противораковых препаратов должны быть дополнительно определены исследованиями in vivo.
4. Conclusions
В этом обзоре мы осветили последние достижения в разработке и применении наночастиц в лечении рака и обобщили преимущества и недостатки основных наночастиц в таблице 3. Наночастицы могут быть пассивно направлены на опухолевые ткани благодаря своему особому размеру. Однако благодаря постоянному развитию нано-инженерии, различные модифицированные поверхностью нано-молекулы могут быть более эффективными и специфически нацеленными на опухолевые клетки. Например, многие наночастицы, модифицированные специфическими лигандами и моноклональными антителами, были использованы в клинических испытаниях и клинических системах транспортировки лекарственных средств. Накопление наночастиц золота в опухолевых клетках будет вызывать стагнацию пролиферации опухолевых клеток и апоптоз, но в то же время будет вызывать аутофагию, чтобы улучшить способность опухолевых клеток противостоять внешним повреждениям. Встраивание анти-аутофагических препаратов в золотые наночастицы может стать решением проблемы. Фототермический эффект золотых и углеродных наночастиц открывает новые возможности для противоопухолевой терапии, основанной на хирургии, радиотерапии и химиотерапии, но их безопасность и доступность требуют дальнейшего изучения и совершенствования. Полимерные наночастицы и наночастицы на основе белка демонстрируют исключительную биосовместимость и низкую токсичность. Липосомные наночастицы широко используются в клинике. Современные исследования и клинические испытания сосредоточены на модификации липосом и встраивании в них полимеров для улучшения их действия. Липосомы, нагруженные новыми химиотерапевтическими препаратами и специальными РНК, демонстрируют различные возможности в лечении различных опухолей. Все большее количество поверхностно-модифицированных частиц в определенной степени улучшило их противоопухолевую специфичность в экспериментах in vitro; это также увеличивает их нестабильность и риск биологической токсичности после метаболизма in vivo. С появлением и быстрым развитием нано-медицины для нас по-прежнему будет огромной проблемой сбалансировать биосовместимость и токсичность в будущем.
Table 3. Major nanoparticles involved in this review and their features.
|


