Пользователи: 
ГЕМАТОПОЭТИЧЕСКИЕ СТВОЛОВЫЕ КЛЕТКИ
Генотерапия гематологических болезней с помощью редакторов оснований
Base Editors-Mediated Gene Therapy in Hematopoietic Stem Cells for Hematologic Diseases Chengpeng Zhang, Jinchao Xu, Yikang Wu, et al.
 Stem Cell Rev and Rep (2024). https://doi.org/10.1007/s12015-024-10715-5
|
Base editors, developed from the CRISPR/Cas system, consist of components such as deaminase and Cas variants. Since their emergence in 2016, the precision, efficiency, and safety of base editors have been gradually optimized. The feasibility of using base editors in gene therapy has been demonstrated in several disease models. Compared with the CRISPR/Cas system, base editors have shown great potential in hematopoietic stem cells (HSCs) and HSC-based gene therapy, because they do not generate double-stranded breaks (DSBs) while achieving the precise realization of single-base substitutions. This precise editing mechanism allows for the permanent correction of genetic defects directly at their source within HSCs, thus promising a lasting therapeutic effect. Recent advances in base editors are expected to significantly increase the number of clinical trials for HSC-based gene therapies. In this review, we summarize the development and recent progress of DNA base editors, discuss their applications in HSC gene therapy, and highlight the prospec

|

Гемопоэтические стволовые клетки (HSCs) пролиферируют с течением времени и потенциально могут дифференцироваться в различные типы зрелых клеток крови [1]. Трансплантация HSCs (HSCsТ) заменяет больные HSCs нормальными HSCs и широко используется для лечения различных заболеваний крови, включая лейкемию, лимфому, серповидно-клеточную болезнь (SCD) и талассемию [2]. HSCsТ можно разделить на аллогенную HSCsТ и аутологичную HSCsТ. При аллогенной HSCsТ существует определенная вероятность развития болезни «трансплантат против хозяина» (GVHD) в результате иммунного отторжения, что может негативно сказаться на здоровье пациентов [3]. В отличие от этого, аутологичная HSCsТ, которая достигается путем редактирования генов, считается более безопасной стратегией. В настоящее время проводятся многочисленные клинические исследования, а эффективность генотерапии на основе HSCs была эффективно подтверждена на нескольких животных моделях благодаря развитию технологий редактирования генов, таких как система CRISPR/Cas и редакторы оснований. Важно отметить, что первый препарат для редактирования генов HSCs, созданный с помощью CRISPR/Cas9, был одобрен FDA для лечения SCD и β-талассемии [4].
Система CRISPR/Cas состоит из кластеризованного регулярно перемежающегося короткого палиндромного повтора (CRISPR) и связанного с ним белка (Cas). Эта система является третьим поколением систем редактирования генов после нуклеазы цинкового пальца (ZFN) и нуклеазы транскрипционного активатора-подобного эффектора (TALEN) [5]. В настоящее время CRISPR/Cas9 является наиболее широко используемой из CRISPR/Cas-систем. Основной принцип работы CRISPR/Cas9 заключается в создании рибонуклеопротеинового комплекса с двумя ключевыми компонентами - одиночной направляющей РНК (sgRNA) и нуклеазой Cas9 - для того, чтобы вызвать двухцепочечный разрыв (DSB) в определенном месте ДНК [6]. Существует два способа репарации геномной ДНК после DSB: гомологически-направленная репарация (HDR) и негомологичное соединение концов (NHEJ) (рис. 1а) [7]. Несмотря на огромный потенциал системы CRISPR/Cas9, она все еще имеет определенные ограничения и недостатки, включая зависимость HDR от делящихся клеток, низкую точность NHEJ и генерацию случайных мутаций вставки или делеции ДНК (indels) [8, 9]. Поэтому срочно требуются новые поколения технологий точного редактирования генов, помимо CRISPR/Cas9.
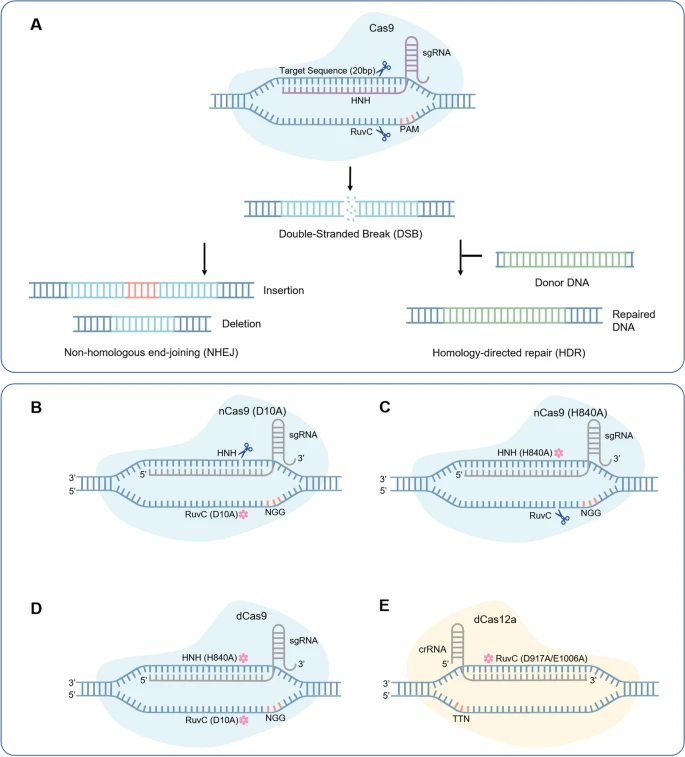 рис. 1
Редактирование генов с помощью системы CRISPR/Cas с использованием четырех вариантов Cas. a Редактирование генов с помощью системы CRISPR/Cas9 для манипулирования генами через различные пути репарации ДНК. b Введение одиночной мутации D10A в структурном домене RuvC Cas9 для получения никаза Cas9 (nCas9 (D10A)). c Введение одиночной мутации HB40A в структурный домен HNH Cas9 для получения nCas9 (H840A). d Введение двойных мутаций D10A и HB40A в структурных доменах RuvC и HNH Cas9, соответственно, для получения каталитически мертвого Cas9 (dCas9). e Введение одиночных мутаций D917A или E1006A в структурном домене RuvC Cas12a для получения dCas12a
Редакторы оснований - это более точные инструменты редактирования генов, которые были разработаны на основе системы CRISPR/Cas9. Сочетая каталитическую активность деаминазы оснований со специфичностью системы CRISPR/Cas для замены определенных оснований в гене-мишени, редакторы оснований могут осуществлять редактирование одного основания с высокой степенью точности, не вызывая DSBs [10]. В недавних исследованиях были разработаны различные редакторы оснований, включая редакторы оснований цитозина (CBE), способные осуществлять переходы от C-G к T-A; редакторы оснований аденозина (ABE), способные осуществлять переходы от A-T к G-C; редакторы оснований гликозилаз (GBE), способные осуществлять переходы от C-G к G-C; и редакторы трансверсий аденина, способные осуществлять переходы от A-T к C-G (рис. 2а) [10-13]. По сравнению с системой CRISPR/Cas редакторы оснований обладают большей эффективностью редактирования и меньшей вне-целевой активностью, поэтому имеют большой потенциал в генотерапии и исследовании заболеваний. В дополнение к базовым редакторам, прайм-редакторы (PEs) являются еще одним типом инструментов для редактирования генов. По сравнению с базовыми редакторами, PEs могут опосредовать целевые вставки, делеции и все 12 возможных переходов от основания к основанию в клетках человека [14]. Несмотря на то, что PEs позволили добиться значительного прогресса в изучении моделей заболеваний, эффективность редактирования, сложность и размер полезной нагрузки PEs все еще остаются серьезными проблемами в генотерапии [15].
 figure 2
Overview of different base editors. a BE3 is capable of the C-G to T-A transition. GBE is capable of C-G to G-C transversion. ABE8e is capable of the A-T to G-C transition. AYBE is capable of A-T to C-G transversion. b Mechanisms of action of BE3, GBE, ABE8e and AYBE. For both BE3 and GBE, the cytidine deaminase rAPOBEC1 enables the deamination of G-C to G-U. Then, the DNA undergoes G-U to A-U mismatch repair since UGI of BE3 inhibits UNG activity. Finally, in DNA repair or replication, T replaces U to realize the desired C-G to T-A transition. In contrast, after deamination, the UNG contained in GBE can excise U to form AP sites, which can lead to a variety of base pairing events, resulting in the desired C-G to G-C transversion in subsequent DNA repair or replication. For ABE8e and AYBE, the adenine deaminase TadA-8e enables the deamination of T-A to T-I. Then, the DNA undergoes T-I to C-I mismatch repair. Finally, in DNA repair or replication, G replaces I to realize the desired A-T to G-C transition. Above is the mechanism of ABE8e. AYBE, on the other hand, contains an MPG that can excise I to form AP sites after deamination, which can lead to a variety of base pairing events, resulting in the desired A-T to C-G and A-T to T-A transversions in subsequent DNA repair or replication
В этом обзоре мы сосредоточились на достижениях в области генной терапии HSCs, опосредованной технологией редактирования оснований. Учитывая обнадеживающий прогресс CRISPR/Cas9-опосредованной генотерапии SCD и β-талассемии, мы обсудили потенциальные возможности применения технологии редактирования оснований, опосредованной генотерапией HSCs, при различных типах наследственных гематологических заболеваний. И наконец, долгосрочная безопасность является главной проблемой для всех методов редактирования генов, используемых в качестве терапевтических стратегий. Поэтому мы кратко обсудили потенциальные события внецелевого редактирования при использовании технологии редактирования оснований.
Overview of Base Editors
From the CRISPR/Cas System to Base Editors
Система CRISPR/Cas, широко используемый инструмент редактирования генов, часто создает побочные продукты indels во время редактирования генома, поскольку система полагается на путь репарации ДНК для достижения интеграции, нокаута и замены генов. Для решения этой проблемы был разработан базовый редактор - инструмент редактирования генов, не вызывающий DSBs. Основными CRISPR/Cas-системами, используемыми в настоящее время для редактирования оснований, являются система CRISPR/Cas9 типа II и система CRISPR/Cas12a типа V.
Система CRISPR/Cas9 состоит из нуклеазы Cas9, CRISPR РНК (crRNA) и трансактивирующей crRNA (tracrRNA) [16, 17]. Нуклеаза Cas9 распознает мотив примыкающего протоспейсера (PAM), который расположен ниже по течению от 3' конца протоспейсера на нецелевой нити ДНК [18]. Затем crRNA и tracrRNA объединяются в sgRNA, которая направляет нуклеазу Cas9 для расщепления ДНК путем комплементарного сопряжения оснований. Система CRISPR/Cas12a состоит из нуклеазы Cas12a и crRNA. Нуклеаза Cas12a распознает PAM перед 5' концом нецелевой нити ДНК и направляется к расщеплению двухцепочечной ДНК с помощью зрелой crRNA [19, 20].
Чтобы уменьшить образование indels и снизить цитотоксичность, в Cas9 и Cas12a были созданы различные точечные мутации. Одиночные точечные мутации (D10A или H840A) и двойные точечные мутации (D10A и H840A) были введены в два структурных домена активной нуклеазы (RuvC и HNH) Cas9, чтобы получить никазу Cas9 (nCas9) (рис. 1б и в) и каталитически dead Cas9 (dCas9) (рис. 1d) соотв. [6,21]. nCas9 расщепляет одноцепочечную ДНК (ssDNA), образуя разрезы, в то время как нуклеазная активность dCas9 исчезает; однако оба белка по-прежнему используют sgRNA для направления связывания с ДНК. Аналогично, внесение точечной мутации (D917A или E1006A) в структурный домен активной нуклеазы RuvC дикого типа Cas12a приводит к образованию dCas12a с не активированной функцией разрезания ДНК (рис. 1e) [22, 23]. Для достижения более точного редактирования генов Komor и другие [10] разработали первое поколение редакторов цитозиновых оснований (BE1), экспрессируя dCas9, слитый с цитозиновой дезаминазой крысы rAPOBEC1. После этой разработки редакторы оснований вошли в стадию редактирования генов, а различные версии редакторов оснований предоставили новые стратегии для генотерапии.
Cytosine Base Editors
Редактор цитозиновых оснований первого поколения (BE1) состоит из крысиной цитозиндезаминазы rAPOBEC1 и dCas9, соединенных гибким линкерным белком XTEN для образования слитого белка rAPOBEC1-XTEN-dCas9. Благодаря двойному действию - комплементарному сопряжению последовательностей sgRNA и протоспейсера и распознаванию последовательностей PAM - dCas9 денатурирует ДНК, в результате чего образуется комплекс dCas9-sgRNA-DNA R-loop, который позволяет цитозиндезаминазе ssDNA катализировать дезаминирование цитозина (C) на нецелевой нити ДНК до урацила (U). Урацил аналогичен тимину (Т) в процессе репликации или репарации ДНК, служит дополнением к аденину (А) и в конечном итоге способствует переходу C-G в T-A. Однако репарация U-G в C-G внутриклеточной урацил-N-гликозилазой (UNG) приводит к неэффективному редактированию BE1 в клетках HEK293T - от 0,8 до 7,7 %. Поэтому в BE2 был введен ингибитор урацил-ДНК-гликозилазы (UGI) из бактериофага B. subtilis PBS1 для подавления внутриклеточной активности UNG, и средняя эффективность редактирования оснований BE2 в клетках HEK293T оказалась в три раза выше, чем у BE1. BE3 создан на основе BE2 путем замены dCas9 на nCas9 (D10A), которая расщепляет нить по остатку гуанина (G), образуя разрез, и запускает механизм репарации несоответствия (MMR) для достижения репарации U-G - U-A. Средняя эффективность редактирования оснований у BE3 в два-шесть раз выше, чем у BE2 [10].
Переход от C-G к T-A, достигаемый с помощью CBE, может сопровождаться переходом от C-G к не-T-A и образованием небольшого количества обнаруживаемых инделов, что снижает чистоту редактируемого продукта. Чтобы повысить чистоту, Komor и другие [24] сконструировали редактор оснований цитозина четвертого поколения, BE4, присоединив к BE3 второй UGI и изменив длину линкерного белка; BE4 лучше подавлял активность внутриклеточного UNG и повышал эффективность редактирования оснований и чистоту продукта. По сравнению с BE3, производство не-Т-оснований с BE4 было снижено в среднем в 2,3 ± 0,3 раза, а частота производства indels - в среднем в 2,3 ± 1,1 раза.
Окно активности - это специфическая область ДНК, в которой редактор оснований осуществляет редактирование оснований, обычно определяемая как несколько нуклеотидов (nt) от последовательности PAM [25]. Например, окно активности BE3 составляет примерно 5 нт, и если последовательность PAM имеет номера с 21 по 23, то окно активности будет иметь номера с 4 по 8 [10]. Редактирование оснований за пределами окна активности менее эффективно. Постороннее редактирование, вероятно, происходит, когда не-целевое основание находится в пределах активного окна [26]. Для уменьшения побочного редактирования исследователи разработали различные редакторы оснований с более узкими окнами активности. Chen и др. [27] сконструировали Td-CBE, внедрив мутацию N46L в аденин-дезаминазу TadA-8e так, чтобы в качестве субстрата для дезаминирования использовался только цитозин. Из этих Td-CBEs eTd-CBEm редактирует только цитозины в положении 5, при этом окно активности сужается до 1 нт, что существенно предотвращает стороннее редактирование. Аналогично, Neugebauer и др. [28] использовали фаг-ассистированную непрерывную эволюцию (PACE) для эволюции TadA-8e, чтобы получить TadA-CDs, которые также используют только цитозин в качестве субстрата, и создали серию небольших и высокоэффективных TadCBEs, сохраняющих характеристики ABEs.
Примечательно, что при создании и оптимизации редакторов оснований использовались различные методы, включая прямую эволюцию, PACE и инструменты искусственного интеллекта (ИИ), которые могут дать дальнейшее представление о будущем развитии редактирования оснований [28-36]. Поэтому мы приводим их краткое описание (табл. 1).
Table 1 Methods and resources involved in the development of base editors
Adenine Base Editors
Приблизительно 14% всех патогенных однонуклеотидных вариаций (SNV) человека можно исправить с помощью перехода C-G в T-A, что может быть достигнуто с помощью CBE. Однако примерно 48 % SNV требуют для коррекции перехода A-T в G-C [37]. Для решения этой проблемы Gaudelli et al. [11] разработали ABE, которые обеспечивают переход A-T в G-C. Аденозин может деаминироваться до инозина, который аналогичен гуанозину и соединяется с цитозином во время репарации или репликации. Исходя из этого, исследователи попытались проверить эффект редактирования природной аденозиндезаминазы, соединив ее с nCas9. Однако, поскольку ни одна из природных аденозиндезаминаз не действует на ssDNA, переход A-T в G-C не был достигнут. Поэтому, чтобы получить аденозиндезаминазу, действующую на ssDNA, команда эволюционировала фермент аденозиндезаминазы трансферной РНК (тРНК) (TadA) из E. coli. После семи эволюционных циклов был получен белок ABE7.10, состоящий из гетеродимера wtTadA-TadA* (wtTadA - TadA дикого типа, а TadA* содержит 14 аминокислотных мутантных участков), который слился с nCas9 и продемонстрировал среднюю эффективность редактирования 53 ± 3,7% в 17 протестированных генных локусах в клетках HEK293T [11]. Koblan и др. [38] сконструировали ABEmax, соединив bpNLS на обоих концах ABE7.10 вместо SV40 NLS; ABEmax продемонстрировал еще большую эффективность редактирования.
Чтобы еще больше улучшить аденозиндезаминазную активность, Richter и другие [32] использовали методы фаг-ассистированной непрерывной эволюции (PANCE) и PACE для эволюции TadA-7.10, деаминазного компонента ABE7.10, чтобы получить TadA-8e. По сравнению с TadA-7.10, TadA-8e содержит восемь дополнительных мутаций, которые увеличивают ее активность в 590 раз. Исследователи сконструировали четыре варианта ABE8e (SpABE8e, SaABE8e, LbABE8e и enAsABE8e) на основе четырех различных Cas-белков (SpCas9, SaCas9, dLbCas12a и enAsCas12a). Среди них SpABE8e продемонстрировал наиболее очевидное увеличение эффективности редактирования оснований по сравнению с ABE7.10, а остальные три варианта расширили область редактирования и привели к значительному увеличению эффективности редактирования [32].
Glycosylase Base Editors
Чтобы разработать редакторы оснований, способные к преобразованию C-G в G-C, Kurt и другие [39] удалили UGI в BE4max, в результате чего был создан BE4maxδUGI, который позволяет немного увеличить преобразование C-G в G-C. Хотя UNG может вырезать урацил с образованием апуриновых/апиримидиновых (AP) сайтов, последующая репарация или репликация ДНК может привести к различным результатам редактирования. Соответственно, исследователи предположили, что слияние человеческих ферментов UNG может повысить эффективность редактирования. Однако продукт слияния BE4maxδUGI-hUNG снижал активность редактирования от C-G до G-C. В ответ на это исследователи ввели мутацию R33A в rAPOBEC1 и сконструировали BE4max(R33A)δUGI-hUNG, который повысил эффективность редактирования и снизил образование indels. Далее исследователи заменили человеческий фермент UNG на фермент UNG из E. coli и соединили его с аминоконцевой частью для создания eUNG-BE4max(R33A)δUGI и CGBE1. Из 18 генных локусов в клетках человека HEK293T четыре показали эффективную активность редактирования C-G в G-C со средней частотой редактирования 41,7-71,5%. Кроме того, исследователи удалили структурный домен eUNG в CGBE1 и сконструировали miniCGBE1, который имел меньший размер. miniCGBE1 значительно снизил частоту генерации indels при незначительном снижении эффективности редактирования по сравнению с CGBE1 [39].
В том же году Zhao et al. [12] аналогичным образом разработали GBE, способные к трансверсии C-G в G-C и C-G в A-T. Среди них исследователи использовали AID E. coli для конструирования AID-nCas9-UNG, который достиг средней эффективности редактирования 87,2 % ± 6,9 % для трансверсии C-G в A-T. В клетках млекопитающих исследователи сконструировали комплекс rAPOBEC1-nCas9-UNG, который обладает высокой эффективностью редактирования в положении 6 протоспейсера, варьирующей от 5,3 до 53,0 % в 30 сайтах [12].
Adenine Transversion Editors
Tong с соавторами [13] предположили, что в клетках млекопитающих может быть индуцирован путь эксцизионной репарации оснований (BER) для достижения редактирования трансверсий A-T в C-G и A-T в T-A. Белок N-метилпурин ДНК-гликозилазы (MPG) человека дикого типа может вырезать гипоксантиновое основание (Hx) в дезоксиинозине (I), образующемся при деаминировании аденина с образованием сайтов AP; за этим шагом следует репарация или репликация ДНК, что также может привести к многочисленным событиям редактирования. Экспериментаторы разработали редакторы адениновых трансверсий (AYBE, Y = C/T) путем слияния ABE8e с MPG. Сначала исследователи соединили MPG с карбонильным концом ABE8e, чтобы сконструировать AYBEv0.1, а затем ввели мутацию N169S в MPG, чтобы сконструировать AYBEv0.2. Затем исследователи провели два раунда скрининга мутаций в AYBEv0.2 на наличие AYBEv1 с MPG-F8V1, а также AYBEv1 с MPG-G163R и N169S из AYBEv2, которые обладают высокой редактирующей активностью. Наконец, чтобы изучить синергетический эффект мутаций AYBEv1 и AYBEv2, исследователи объединили мутации в AYBEv3. По сравнению с AYBEv0.1, активность AYBEv3 по редактированию трансверсий была синергически усилена в 4,78 раза, при этом редактировались преимущественно трансверсии A-T в C-G, а эффективность редактирования всех трансверсий достигала 72%.
Mitochondrial Base Editors
Митохондрии имеют решающее значение для дифференцировки и детерминации HSCs [40]. Увеличение количества мутаций митохондриальной ДНК (мтДНК) в HSCs может приводить к задержке очистке рецептора трансферрина (TfR), что приводит к увеличению количества свободного железа, модификации клеточной мембраны эритроцитов, а впоследствии к уменьшению продолжительности жизни эритроцитов, что приводит к митохондриальной анемии [41]. Было показано, что точечные мутации в гене субъединицы I цитохромкоксидазы (MT-CO1) могут приводить к развитию приобретенной идиопатической сидеробластической анемии [42]. Таким образом, ожидается, что редактирование оснований мтДНК в HSCs станет еще одной мишенью для лечения заболеваний крови. Первые митохондриальные редакторы оснований цитозина (DdCBEs) - это РНК-безрецепторные DddA-производные. Исследователи описали межбактериальный токсин под названием DddA, который опосредует деаминирование dsDNA. DdCBEs состоит из двух нетоксичных расщепленных половинок DddA, белков массива транскрипционных активатор-подобных эффекторов (TALE) и UGI, катализирующих переход C-G в T-A в мтДНК [43]. После DdCBEs был разработан другой тип митохондриальных редакторов оснований, названных TALE-связанными деаминазами (TALEDs), которые опосредуют переходы A-T в G-C в мтДНК [44]. Разработка митохондриальных редакторов оснований привела к выявлению потенциальных терапевтических мишеней для лечения заболеваний HSCs, вызванных мутациями мтДНК.
Advances in Base Editor-Mediated Hematopoietic Stem Cell Gene Therapy
Благодаря разнонаправленному дифференцировочному потенциалу HSCs, их генный монтаж позволяет осуществлять долговременную генную коррекцию в различных линиях [45]. Способность к самообновлению позволяет постоянно передавать генные модификации клеткам-потомкам путем точного редактирования генома HSCs [46]. Таким образом, HSCs являются идеальной мишенью для генотерапии. Кроме того, базовые редакторы без DSB являются более точными и безопасными, чем другие инструменты редактирования генов, что позволяет эффективно редактировать геном HSCs. Таким образом, генотерапия с помощью редакторов оснований в HSCs может быть использована для лечения различных заболеваний, в том числе гемоглобинопатий и иммунодефицитных состояний.
Ex Vivo
Основными гемоглобинопатиями являются SCD и β-талассемия. SCD - аутосомно-рецессивное гемолитическое заболевание, характеризующееся серповидностью эритроцитов при низких концентрациях кислорода. В основе патогенеза этого заболевания лежит мутация A > T в гене субъединицы гемоглобина бета (HBB), в результате которой образуется аллель βS, приводящий к замене глутаминовой кислоты на валин в положении 6 зрелой цепи β-глобина. У лиц с одним аллелем βS нет явных клинических проявлений, а у лиц с двумя аллелями βS (βS/βS) наблюдается SCD [47]. Основными клиническими проявлениями SCD являются желтуха, анемия и гепатоспленомегалия [48].
В настоящее время возможности лечения SCD ограничены. В предыдущих исследованиях были проведены клинические испытания с использованием системы CRISPR/Cas9 для лечения пациентов. Однако стратегии генотерапии, основанные на системе CRISPR/Cas9, привели к ряду побочных явлений [49]. Сообщалось, что восстановление двунитевых разрывов, индуцированных CRISPR/Cas9, приводит к большим делециям и сложным перестройкам [50]. Кроме того, редактирование глобина с помощью CRISPR/Cas9 может вызывать мегабазовые потери гетерозиготности в гемопоэтических клетках [51]. Учитывая многочисленные негативные последствия, вызываемые DSBs, выбор редакторов оснований без DSBs для генной терапии HSCs может свести к минимуму вышеуказанные неблагоприятные события. Ньюби и др. [52] использовали ABE8e-NRCH для исправления патогенных точечных мутаций в HSCs пациентов с SCD ex vivo. ABE8e-NRCH преобразовал ген β-глобина SCD (HBB S) в непатогенный ген β-глобина Makassar (HBB G) (рис. 3а). Патогенные белки β S были снижены в 5,1 раза в отредактированных клетках по сравнению с необработанными. После того как исследователи доставили рибонуклеопротеиновые комплексы (RNPs) ABE8e-NRCH путем электропорации в HBB S/S HSPCs от мышей SCD и трансплантировали их мышам, у мышей SCD было в среднем 75-82% общего β-глобина, трехкратное снижение серповидных клеток, вызванных гипероксией, и возвращение к почти нормальному размеру селезенки. Недавно Everette и другие [53] использовали PE3max для редактирования HSPC от пациентов с SCD ex vivo, при этом эффективность редактирования HBB S составила 15-41%. Через 16 недель после трансплантации отредактированных HSPC иммунодефицитным мышам в среднем 42 % человеческих эритроцитов и ретикулоцитов экспрессировали HBB A, что улучшило симптомы анемии.

figure 3
Experimental base editor-based gene therapy for hematopoietic stem cells. a Ex vivo base editing. First, HSPCs from the SCD mouse model were extracted, and ABE8e mRNA and sgRNA were subsequently introduced into unedited HSPCs by electroporation. Second, the edited HSPCs and the unedited HSPCs were transplanted into two groups of C57BL/6 mice. Finally, after 16 weeks, most of the erythrocytes in the mice transplanted with the edited HSPCs returned to normal, while most of the erythrocytes in the mice transplanted with the unedited HSPCs were sickle cells. b In vivo base editing. The vector delivering the base editor was introduced into the SCD mouse model by intravenous injection. The delivery routes included transfection of HSCs with HDAd5/35++ vectors and targeting of LNPs to CD117 on the surface of HSCs with an anti-CD117 antibody. A preponderance of normal erythrocytes was observed in blood extracted after 16 weeks. Created with BioRender.com Бета-талассемия - аутосомно-рецессивное заболевание крови, характеризующееся снижением синтеза (β+) или делецией (β0) β-глобиновой цепи тетрамера гемоглобина и классифицируемое на три типа: талассемия малая, талассемия промежуточная и талассемия большая [54]. Среди них малая талассемия не имеет явных клинических симптомов, а большая талассемия клинически проявляется задержкой роста, бледностью, желтухой, гепатоспленомегалией и деформацией скелета [55].
Прямая коррекция патогенных точечных мутаций с помощью редактирования оснований для восстановления β-глобина может быть использована для лечения β--талассемии. IVS1-110 (G > A) - одна из наиболее распространенных мутаций у пациентов с Ближнего Востока и Средиземноморского региона. Hardouin et al. [56] ввели электропорацию sgRNAs в HSPC пациентов с β-талассемией с мРНК SpRY-ABE8e для исправления мутации G > A. В обработанных эритроцитах экспрессировался более высокий уровень β-глобина. Далее исследователи пересадили отредактированные HSPC мышам с иммунодефицитом, и в группе мышей с коррекцией экспрессия β-глобина и соотношение α-глобин/неα-глобин были эффективно восстановлены по сравнению с группой мышей, которым были пересажены не отредактированные SpRY-ABE8e HSPC.
Фетальный гемоглобин (HbF), состоящий из γ-глобина и α-глобина, содержится в высоком количестве у новорожденных. Взрослые преимущественно экспрессируют гемоглобин взрослых (HbA) с минимальным количеством HbF [57]. Стратегии генной терапии при SCD и β-талассемии основаны на повышении уровня HbF для компенсации дефектов в уровне HbA, что является универсальным подходом к лечению гемоглобинопатий [58-60]. Zeng et al. [60] ввели A3A (N57Q)-BE3, который с помощью sgRNA нацелен на энхансер + 58 эритроидного фактора транскрипции BCL11 (BCL11A), в CD34+ HSPC человека и индуцировали выработку HbF путем редактирования оснований, чтобы нарушить энхансер BCL11A эритроидного фактора. Исследователи отредактировали CD34+ HSPC от двух пациентов с β-талассемией с эффективностью редактирования 93,3 и 90,6 % и наблюдали увеличение размера эритроцитов и более округлую форму эритроцитов. Недавно Mayuranathan et al. [61] ввели мутацию A-T - G-C в позиции -175 п.н. перед стартовым сайтом транскрипции γ-глобина посредством ABE8e, которая эффективно индуцировала выработку HbF и привела к значительному снижению количества серповидных клеток, вызванных гипоксией. Редактирование основания -175A > G было более эффективным для индуцирования HbF, чем использование Cas9 для разрушения эритроидного энхансера + 58 BCL11A или BCL11A-связывающего мотива промотора глобина.
Кроме гемоглобинопатий, генотерапия с редактированием оснований в HSCs/HSCs в настоящее время широко не используется, за редким исключением. Fanconi anemia (FA) - редкое аутосомное или Х-сцепленное рецессивное заболевание, характеризующееся апластической анемией, предрасположенностью к раку и аномалиями развития. Отличительной особенностью FA является нарушение способности организма поддерживать целостность генома, что приводит к ускоренному накоплению ключевых генетических изменений, способствующих трансформации клеток и повышающих вероятность развития рака. Мутации в любом из генов пути FA-BRCA, включая группу комплементации FA (FANCA), FANCC и FANCG, могут вызывать FA [62]. Siegner et al. [63] использовали ABE8e для редактирования CD34+ HSPC ex vivo от трех пациентов с FA, имеющих мутацию FANCA c.295 C > T. Через пять дней после электропорации эффективность редактирования составила 57,51 ± 21,00 %, 64,37 % и 42,22 % для трех пациентов. Этот результат продемонстрировал высокую эффективность ABE8e для редактирования HSPC от пациентов с FA. Однако из-за крайней нехватки HSPC, полученных от пациентов с FA, исследователи не пересадили отредактированные ABE8e клетки иммунодефицитным мышам, чтобы проверить, насколько эффективным было редактирование генов ex vivo. Мы ожидаем, что соответствующие испытания восполнят этот пробел в будущем.
Тяжелый комбинированный иммунодефицит CD3d (SCID) - аутосомное заболевание, вызванное точечной мутацией (c.202C > T) дельта-субъединицы CD3 комплекса Т-клеточных рецепторов (CD3D). У пациентов наблюдается снижение количества αβ Т-клеток и αδ Т-клеток, что часто приводит к младенческой смертности [64]. McAuley et al. [65] впервые точно восстановили мутацию CD3D c.202C > T в HSPCs от пациентов с CD3d SCID ex vivo с помощью ABEmax-NRTH, при этом коэффициент коррекции патогенной мутации составил 71,2 % ± 7,85 %. Далее, чтобы изучить способность ABEs исправлять мутации в долгосрочной перспективе в HSPCs от пациентов с CD3d SCID, исследователи электропорацией мРНК, кодирующей ABEmax-NRTH, и sgRNA в человеческие CD34+ HSPCs от здоровых доноров, трансдуцированные лентивирусными векторами, несущими мутацию CD3D c.202C > T, и трансплантировали их иммунодефицитным мышам. Через 16 недель после трансплантации у мышей наблюдалась стойкая эффективность редактирования во всем костном мозге, селезенке и тимусе, а изменений в кроветворении обнаружено не было. Наконец, чтобы выяснить, можно ли использовать отредактированные ABE CD3d SCID HSPCs для восстановления нормальной функции Т-клеток, авторы использовали 3D искусственные тимические органоиды (ATOs) для определения поверхностной экспрессии CD3 и Т-клеточного рецептора (TCR) в HSPCs. Результаты показали, что коэкспрессия TCR и CD3 на поверхности ATOs от пациентов, подвергшихся ABE-редактированию, была значительно увеличена в двухположительных (DP, CD4 + CD8 +) Т-клетках, одноположительных восьми (SP8, CD3 + TCRaЯ + CD4-CD8a + CD8Я +) Т-клетках и одноположительных четырех (SP4, CD3 + TCRaЯ + CD4 + CD8a-) Т-клетках. Полученные результаты свидетельствуют о том, что генотерапия, опосредованная ABE, восстанавливает развитие Т-клеток у пациентов с CD3δ SCID, предлагая подход к лечению этого заболевания.
In Vivo
Приведенные выше экспериментальные результаты представляют собой многообещающую стратегию лечения серповидно-клеточной болезни, β-талассемии и других не злокачественных заболеваний кроветворной системы с использованием редакторов оснований для модификации аутологичных HSCs ex vivo и последующей трансплантации этих клеток в организм для восстановления дефектной экспрессии гемоглобина. Однако такая терапия аутологичными стволовыми клетками не только дорогостоящая, но и более болезненная для пациентов, что может привести к системным повреждениям, таким как инфекции и рак. По сравнению с редактированием ex vivo, редактирование HSCs in vivo технически намного проще, поскольку препарат может быть доставлен простой внутривенной инфузией, и нет необходимости в пред-трансплантационном кондиционировании, которое может привести к токсичности. Поэтому в будущем этот подход может стать основным направлением в лечении незлокачественных заболеваний кроветворной системы.
Прежде чем обсуждать терапевтические возможности редакторов оснований, необходимо кратко описать стратегии доставки базовых редакторов in vivo, которые имеют решающее значение для терапевтической эффективности. Векторы доставки должны быть соответствующего размера, чтобы инкапсулировать ДНК или мРНК редактора оснований, и иметь на своей поверхности соответствующие молекулы для связывания с рецептором на поверхности HSCs [66]. В целом, векторы доставки можно разделить на вирусные и невирусные. Существует три основных типа вирусных векторов: аденовирусные, лентивирусные и адено-ассоциированные вирусные векторы, среди которых наиболее широко в HSCs используются аденовирусные векторы. Аденовирусы представляют собой частицы диаметром 90-100 нм без оболочки, состоящие из 252 капсидов, расположенных в 20-гранной конфигурации. Геном широко используемого аденовируса человека типа 5 (Ad5) составляет около 36 кб [67]. У хелпер-зависимых аденовирусов (HDAd) отсутствует вирусная кодирующая область, что позволяет им вызывать незначительный клеточный иммунный ответ. Кроме того, они обладают большой способностью к клонированию, что делает их подходящими для использования в качестве эффективных векторов доставки [68]. Широко используемой системой доставки редакторов оснований в HSCs является векторная система переноса генов HDAd5/35++, созданная группой Lieber's, которая может эффективно нацеливаться на CD46 на поверхности HSCs. К преимуществам этого вектора относятся высокая производительность, низкая стоимость производства и отсутствие значительной цитотоксичности [69]. Недавно сообщалось об использовании липидных наночастиц (LNPs) для доставки базовых редакторов, которые могут непосредственно модифицировать гемопоэтические стволовые клетки in vivo [70]. В настоящее время LNPs не так часто используются для редактирования HSCs in vivo по сравнению с вирусными векторами. Будучи перспективным вектором доставки, они приводят к преходящей экспрессии базовых редакторов, что снижает вероятность вне-целевого редактирования. Однако после введения в кровь ЛLNPs покрываются липопротеинами ApoE, что приводит к поглощению их печенью. Поэтому их часто используют для редактирования генов в печени, но именно по этой причине они не нацелены точно на HSCs, что может снизить терапевтическую эффективность in vivo [66].
Li и другие [71] разработали in vivo терапию редактирования оснований на основе хелпер-зависимых аденовирусов 5/35++ (HDAd5/35++), которые нацелены на CD46, экспрессируемый на HSPCs. Исследователи использовали ABEmax для реконструкции наследственной персистенции фетального гемоглобина (HPFH) мутациями в промоторе гемоглобиновой субъединицы гамма 1/2 (HBG1/2) (рис. 3б). Через 16 недель после введения вектора уровень γ-глобина в эритроцитах периферической крови мышей увеличился с 1 до 43 %. Аналогичным образом исследовательская группа использовала разработанный вектор HDAd-EF1α для доставки ABE8e мышам β-YAC/CD46 путем внутривенной инъекции. Вектор ABE8e нацелен на CD46, экспрессируемый на примитивных HSCs. Используя ABE8e для установки мутации -113 A > G HPFH в промотор HBG1/2, исследователи добились эффективности редактирования in vivo более 60 %, а содержание γ-глобина в эритроцитах периферической крови значительно увеличилось [72]. Исследовательская группа также использовала векторы HDAd5/35++ для доставки PEs путем внутривенной инъекции в мышиную модель SCD для исправления мутаций HBBS. Эффективность редактирования in vivo у мышей составила в среднем 43,6% после 16 недель внутривенного введения. По сравнению с мышами, не получавшими лечения, 43 % серповидного гемоглобина (HbS) было восстановлено до HbA, а процент серповидных клеток снизился с 86 % до 29,6 % в образцах крови, полученных от мышей, отредактированных свинцом in vivo. Более того, размер селезенки у отредактированных мышей значительно уменьшился [73].
Breda et al. [70] сконструировали LNPs, нацеленный на HSCs; антитело CD117 на поверхности LNPs связывается с антигеном CD117 на HSCs, что позволяет LNPs точно доставлять мРНК ABE и sgRNA в HSCs. Этот метод позволяет модифицировать HSCs in vivo путем простой внутривенной инъекции с меньшим количеством побочных эффектов, открывая новые возможности для лечения наследственных заболеваний крови. С постоянным развитием технологий и углубленными исследованиями ожидается дальнейшее развитие in vivo редактирования как терапии HSCs и его применение для лечения все большего числа заболеваний (табл. 2).
Table 2 Advances in base editing technology-mediated hematopoietic stem cell gene therapy
Однако in vivo редактирование HSCs все еще имеет недостатки, такие как воспалительная реакция, возникающая при внутривенном введении. Кроме того, длительное присутствие аденовирусных векторов в организме может повысить риск развития рака [74]. Другая более серьезная проблема заключается в том, что, поскольку рецептор CD46 для HDAd5/35++ экспрессируется на всех ядро-содержащих клетках, вирусные векторы могут трансдуцироваться в не-гемопоэтические ткани; например, векторные геномы были обнаружены в печени и легких [73]. Такая вне-целевая трансдукция может увеличить вероятность нежелательных генетических модификаций и нанести вред здоровью пациента. Поэтому поиск рецепторов, которые более специфично экспрессируются на HSCs, например рецепторов факторов стволовых клеток, является ключом к повышению эффективности редактирования и специфичности редактирования in vivo.
Prospects of Base Editor-Mediated Hematopoietic Stem Cell Gene Therapy for Different Inherited Hematologic Diseases
Erythrocyte Disease
α-Талассемия - аутосомно-рецессивное заболевание, проявляющееся дефектом выработки α-глобина в HbA (α2β2). α-Глобин регулируется двумя α-глобиновыми генами на каждой паре хромосомы 16, генотип нормальных людей - αα/αα. В зависимости от типа мутации заболевание можно разделить на делеционную α-талассемию и неделеционную α-талассемию. α0-талассемия означает полное отсутствие хромосомной экспрессии гена α, в то время как α+-талассемия означает низкую регуляцию хромосомной экспрессии гена α. Не делеционная α+-талассемия, как правило, протекает тяжелее, чем делеционная α-талассемия [75].
Подобно индукции выработки γ-глобина при лечении β-талассемии и SCD, активация эмбрионально экспрессированного -глобина также компенсирует недостаток α-глобина. King et al. [76] сообщили, что δ-ген взаимодействует с суперэнхансером α-глобина в эмбриональных эритроидных клетках и находится внутри субтопологически ассоциированного домена (sub-TAD) размером ~ 65 кб, состоящего из открытого, ацетилированного хроматина. Однако во взрослых эритроидных клетках ζ-ген находится в субдомене гипоацетилированного факультативного гетерохроматина размером около 10 кб внутри ацетилированного суб-TAD, и он больше не контактирует со своими энхансерами [76]. Таким образом, реактивация гена ζ- в HSCs может стать потенциальным способом лечения α-талассемии. Кроме того, Li и др. [77] использовали систему CRISPR/Cas9 для исправления мутации Hb WS в гене гемоглобина альфа 2 (HBA2) человека. Редактируемые клетки представляли собой индуцированные плюрипотентные стволовые клетки человека (hiPSCs), полученные из амниотических клеток пациента, и могли дифференцироваться в гемопоэтические клетки-предшественники ex vivo [77]. Таким же образом не-делецитационные типы α-талассемии, вызванные мутациями одного гена, такие как Hb Constant Spring (Hb CS, c.427 T > C), Hb Quong Sze (Hb QS, c.377 T > C) и Hb Westmead (Hb WS, c.369 C > G), теоретически могут быть исправлены с помощью редакторов оснований в HSCs.
Diamond–Blackfan anemia (DBA) - аутосомно-доминантная форма гипоплазии эритроцитов, обусловленная в основном патогенными зародышевыми вариантами генов рибосомальных белков, таких как рибосомальный белок S19 (RPS19), RPS24, RPS17, RPL5, RPL11 и RPL35A, с такими клиническими проявлениями, как тяжелая анемия, скелетные пороки развития и предрасположенность к раку [78]. Недавно было показано, что биаллельные варианты в HEAT-повторе, содержащем 3 (HEATR3), приводят к нарушению ядерного импорта uL18 (RPL5) и эритропоэза, в результате чего развивается DBA [79]. В настоящее время лечение DBA основано на кортикостероидной терапии, хронической инфузии эритроцитов или HSCT [80]. Терапия, основанная на редактировании оснований HSCs, может стать альтернативной стратегией лечения DBA в будущем.
Primary Immunodeficiency Disease
Синдром Wiskott–Aldrich (WAS) - это Х-сцепленное рецессивное иммунодефицитное заболевание, характеризующееся тромбоцитопенией, экземой, рецидивирующими инфекциями, повышенным риском аутоиммунных заболеваний и злокачественных новообразований. Мутации в гене фактора, способствующего зарождению актина WASP (WAS), приводят к нарушению синтеза белка WAS (WASp), экспрессируемого почти во всех гемопоэтических клетках и участвующего в полимеризации актинового каркаса; снижение уровня этого белка приводит к нарушению функции иммунных клеток. В настоящее время эффективным методом лечения является HSCT [81]. Существует множество патогенных мутаций WAS; Jin et al. [82] идентифицировали и охарактеризовали в общей сложности 141 уникальную мутацию WAS, наиболее распространенными из которых были миссенс-мутации. Rai et al. [83] разработали стратегию генотерапии на основе CRISPR/Cas9, позволяющую транскрипционно регулировать регионы, регулируемые WAS, путем нокаутирования терапевтической кДНК WAS с эндогенными кодонами инициации трансляции в HSPC пациентов. Это универсальная стратегия для всех мутаций. Однако CRISPR/Cas9 более генотоксичен, чем редакторы оснований, для редактирования HSPCs ex vivo (обсуждалось ранее), что потенциально может привести к некоторым побочным эффектам. Среди всех мутаций WAS наиболее распространены точечные мутации c.168C > T, c.290C > N/291G > N и c.665C > T, которые могут быть использованы в качестве целевых сайтов для in situ ремонта редакторами оснований [82].
SCIDs - это группа редких врожденных заболеваний, характеризующихся нарушением гуморального и клеточного иммунитета, лейкопенией и низким или отсутствующим уровнем антител [84]. Ранее сообщалось о редактировании оснований против CD3d SCID. Однако наиболее распространенным типом является Х-сцепленный СКИД, вызванный мутациями в гене гамма-субъединицы рецептора интерлейкина 2 (IL2RG). Среди всех точечных мутаций IL2RG наиболее распространенными и подходящими для редактирования оснований являются c.690C > T, c.691G > A, c.684C > T, c.879C > T и c.868G > A [85]. Что касается WAS, то сообщалось об использовании CRISPR/Cas9 для редактирования HSCs для лечения Х-сцепленного SCID [86].
X-linked agammaglobulinemia (XLA) - еще одно первичное иммунодефицитное заболевание, вызванное мутациями в гене тирозинкиназы Брутона (BTK). Мутации в гене BTK приводят к дефектному синтезу тирозинкиназы Bruton (BTK), что приводит к нарушению созревания пре-В-клеток в В-клетки [87]. В настоящее время первой линией лечения XLA является внутривенная заместительная терапия гаммаглобулином (IVIG) и HSCsТ. В Китае наиболее распространенные рецидивирующие точечные мутации в BTK находятся в аргинин-кодирующих CpG-динуклеотидах, например c.1559 G > A. Поэтому соответствующие точечные мутации могут быть объектами для репарации in situ путем редактирования оснований [88].
Metabolic Diseases
В отличие от вышеупомянутых заболеваний, болезнь Gaucher (GD) является метаболическим заболеванием, для лечения которого генотерапия также может быть достигнута путем редактирования HSPCs. GD, вызванная мутациями в гене глюкозилцерамидазы бета 1 ( GBA1), является редким аутосомно-рецессивным генетическим заболеванием. Гликолипиды накапливаются в макрофагах из-за дефицита глюкоцереброзидазы (GCase), что приводит к таким клиническим симптомам, как гепатоспленомегалия, анемия и заболевания костей [89]. В предыдущем исследовании Scharenberg et al. [90] использовали системы CRISPR/Cas9 и адено-ассоциированного вируса (AAV) для нацеливания кассет экспрессии GCase на локус безопасного укрытия CCR5 человека в HSPCs, что позволило реализовать экспрессию GCase в линиях моноцитов/макрофагов. Из всех точечных мутаций GBA1 мутация N370S (c.1226 A > G) является наиболее распространенной, поэтому она представляет собой потенциальный сайт для репарации in situ путем редактирования оснований [91] (табл. 3).
Table 3 Prospects of base editors-mediated hematopoietic stem cell gene therapy
Off-Target Editing by Base Editors
Вне-целевое редактирование с помощью редакторов оснований является основным препятствием, ограничивающим их клиническое применение. Вне-целевое редактирование, вызываемое редакторами оснований, можно разделить на три основные категории: Cas-зависимое редактирование вне мишени, Cas-независимое редактирование вне мишени и редактирование вне мишени РНК. CBE и ABE могут распознавать небольшое количество сайтов off-target и выполнять редактирование C-G to T-A или A-T to G-C вне мишени в пределах активного окна. Эти off-target сайты имеют сходные последовательности с sgRNAs, и редактирование в этих сайтах обусловлено степенью неспецифичности нуклеазы Cas9, которая позволяет ей переносить несоответствия оснований; этот процесс называют Cas-зависимым off-target редактированием [25, 92, 93]. Недавно было обнаружено, что несовпадения, допускаемые нуклеазой Cas9, достигаются за счет образования неканонических пар оснований [94].
Чтобы избежать Cas9-зависимого редактирования вне цели, исследователи разработали ряд высокоточных нуклеаз Cas9 и сконструировали соответствующие редакторы оснований. Rees et al. [95] ввели четыре точечные мутации в высокоточный вариант Cas9 HF-Cas9 в BE3, сконструировав HF-BE3, который был разработан для устранения неспецифических взаимодействий между Cas9 и ДНК. В высокоповторяющемся сайте VEGFA2 HF-BE3 продемонстрировал трехкратное снижение эффективности вне-целевого редактирования [95]. Lee et al. [96] создали модель направленной эволюции в E. coli, отсеяли ее для получения Sniper-Cas9 с высокой специфичностью для целевых последовательностей и сконструировали Sniper-BE3, который показал в 2,4-16,2 раза большую эффективность редактирования специфических off-target сайтов, чем Cas9-конструированный BE3 дикого типа. Кроме того, исследователи показали, что доставка через RNPs может сократить продолжительность действия редактора оснований в клетке по сравнению с доставкой через плазмиды, аналогично уменьшая Cas-зависимое редактирование вне мишени [96].
Помимо неспецифичности Cas9, приводящей к off-target редактированию, неспецифичность деаминаз также может приводить к off-target редактированию и чаще всего встречается в CBE. Zuo et al. [97] использовали самостоятельно разработанную технологию мониторинга вне-целевого редактирования с помощью геномного анализа через двухклеточную инъекцию эмбриона (GOTI) и заметили, что количество SNV, индуцированных BE3 в эмбрионах мыши, было намного больше, чем индуцированных ABE или CRISPR/Cas9, и это вне-целевое редактирование было трудно предсказать с помощью существующих методов предсказания вне-целевого редактирования. Jin et al. [98] также наблюдали подобные результаты на рисе. Эти SNV были преимущественно от C-G в T-A, а регионы, содержащие SNV, не были похожи на последовательности sgRNA, что позволяет предположить, что эти вне-целевые правки не зависят от нуклеазы Cas9 и вызваны случайным деаминированием; поэтому они называются Cas-независимыми вне-целевыми правками [98].
Чтобы избежать Cas-независимого редактирования вне мишени, исследователи оптимизировали деаминазы, изменив их активность деаминирования. Doman и другие [99] ввели точечные мутации в деаминазы и сконструировали CBE, включая R33A + K34A-BE4 и R33A + K34A + H122L + D124N-BE4 (известный как AALN-BE4), которые снизили Cas-независимое редактирование вне мишени до менее чем 0,4%. Yu et al. [100] разработали восемь CBE нового поколения с низкой вне-целевой активностью, которые продемонстрировали примерно такую же эффективность редактирования и общее снижение до 45 раз в Cas-независимом вне-целевом редактировании по сравнению с BE4. Yuan и др. сконструировали цитозиндезаминазу APOBEC3A для создания eA3A-RL1 путем введения точечной мутации N57G, а также путем введения области петли узнавания RL1 APOBEC3G вместо оригинальной RL1. Впоследствии исследователи использовали стратегию слияния N-концов для получения вышеупомянутого мутанта деаминазы N-eA3A-RL1-BE, который продемонстрировал надежную активность редактирования с минимизацией Cas-независимых вне-целевых правок [101]. Кроме того, Zhang et al. [102] разработали серию мини-CBE путем слияния перепрограммированной деаминазы TadA-8e с Cas12f, что привело к устранению Cas-независимых off-target эффектов, сравнимых с данными Doman et al [99].
Помимо этих двух типов редактирования, CBEs или ABEs могут также вызывать деаминирование РНК на транскрипционном уровне в клетках человека, что приводит к редактированию РНК вне мишени [103]. Чтобы оптимизировать редакторы оснований, которые могут избирательно избегать редактирования РНК, Grünewald и др. [104] отобрали два варианта rAPOBEC1 и использовали их для конструирования BE3 (R33A) и BE3 (R33A/K34A), которые были названы SECURE-BE3. Далее исследователи сконструировали miniABEmax (K20A/R21A) и mini ABEmax (V82G), названные SECURE-ABEs [104]. Все эти варианты значительно снижали количество редактирования РНК в клетках человека.
Нельзя игнорировать генотоксические эффекты редактирования оснований ex vivo в HSCs, что тесно связано с эффектом редактирования оснований вне мишени. Fiumara et al. [105] нацелились на ген бета-2-микроглобулина (B2M) с помощью BE4max и ABE8.20-m, чтобы проверить их нокаутирующий эффект на HSCs. Секвенирование показало, что редактирование с помощью BE4max привело к образованию indels в целевом сайте более чем в 1/3 аллелей. BE4max также вызывал активацию пути p53, а все редакторы оснований в этом исследовании также активировали ответы интерферона альфа (IFNα) и IFNγ Более того, исследователи показали, что BE4max ухудшает долгосрочное приживление отредактированных HSPC, чего не наблюдалось в случае с ABE [105]. Это различие может быть связано с большим количеством вне-целевого редактирования, вызванного CBE. Yan et al. [106] наблюдали аномальный фенотип ожирения и задержки развития у мышей с постоянной избыточной экспрессией гена BE3 в ходе длительного мониторинга, а две мертвые мыши с задержкой развития, сверхэкспрессирующие ген BE3, несли в пять раз больше мутаций ДНК по сравнению с контрольной группой. Таким образом, особенно важно обеспечить минимизацию вне-целевого редактирования редакторов оснований. Создание более точных методов обнаружения off-target и дальнейшее развитие высокоточных редакторов оснований поможет быстрее внедрить технологию редактирования оснований в клиническую практику. Помимо генотоксичности редакторов оснований, еще одним серьезным препятствием является врожденная иммунная система организма. Ex vivo модификация генома HSCs может привести к экспрессии неоантигенов, что может вызвать иммунный ответ [74].
Improving the Editing Efficacy of Base Editors in HSCs
Selecting Appropriate Base Editors
Во всех экспериментах, в которых использовались редакторы оснований для модификации HSCs, большинство редакторов оснований были ABE (табл. 4). Этот результат согласуется с предыдущими сообщениями о том, что CBE приводят к большому количеству вне-целевых правок, а также к генотоксичности HSCs [97, 105]. Поэтому мы считаем, что для редактирования HSCs лучше выбирать ABE, а не CBE, чтобы избежать негативных последствий, связанных с редактированием вне цели. Однако последние достижения, такие как TadCBEs и tBEs, значительно уменьшили Cas-независимое редактирование вне мишени по сравнению с другими CBEs и, таким образом, могут иметь перспективы в HSCs [28, 107].
Table 4 The three most common base editors for therapeutic gene editing in HSCs
Помимо выбора редакторов оснований с низкой off-target активностью, при выборе редакторов оснований для редактирования генов HSCs следует обратить внимание на следующие моменты: 1. Рестрикция PAM. В настоящее время большинство BE используют нуклеазу SpCas9, которая распознает NGG PAM [18]. Однако это может ограничивать область редактирования редакторов оснований. Поэтому можно выбрать редакторы оснований, не ограниченные PAM-последовательностями. Например, SpRY-ABE, как сообщается, эффективно восстанавливает мутацию β-талассемии IVS1-110 (G > A) [56, 108]. 2. Чистота продукта. В редакторе оснований может быть индуцировано небольшое количество indels и побочных продуктов, которые могут снижать эффективность редактирования HSCs. Например, высокочастотные indels в эритроидном энхансере BCL11A нарушают функциональные мотивы GATA, тем самым препятствуя эффективному нарушению энхансерной активности [61]. Чтобы избежать этого недостатка, можно выбрать редакторы оснований, снижающие частоту indels, такие как BE4-GAM [24]. 3. Bystander редактирование. Если bystander редактирование неизбежно и может привести к неблагоприятным результатам, следует выбирать редакторы оснований с узким окном активности или с контекстным предпочтением, чтобы избежать bystander редактирования. Например, A3A (N57Q)-BE3, выбранный Zeng et al. [60]. Этот редактор оснований предпочитает деаминировать цитозин в мотивах TCR, что приводит к мощной индукции HbF in vivo [109]. Однако возникновение побочного редактирования в HSCs не всегда может быть губительным. Иногда побочное редактирование может способствовать повышению эффективности редактирования in vivo. Например, ABE способствует активации HbF, достигая перехода -113A > G для разрушения BCL11A в промоторе HBG1/2. В этом процессе побочное редактирование в сайте -116 способствует разрушению BCL11A, тем самым еще больше способствуя активации HbF [72]. В этом случае для достижения максимальной эффективности редактирования можно выбрать редактор оснований с соответствующим расширенным окном активности.
Minimizing Genetic Heterogeneity
Инструменты редактирования генов, особенно CRISPR/Cas9, создающий DSBs, обычно приводят к генерации генетически гетерогенных популяций HSCs [110]. По сравнению с CRISPR/Cas9, редакторы оснований без DSB создают менее гетерогенные популяции, но это все равно нельзя игнорировать. Вкратце, генетическая гетерогенность, вызванная редакторами оснований, возникает из трех основных источников: вне-целевое редактирование, побочные продукты и indels. Это может быть потенциально вредным для генотерапии. Поэтому, чтобы минимизировать эффект генетической гетерогенности в популяции HSCs, существуют следующие меры. 1. Выбирать редакторы оснований с низкой вне-целевой активностью, меньшим количеством побочных продуктов и пониженной частотой indels (обсуждалось ранее). Стоит отметить, что все эти три недостатка более выражены у CBE, чем у ABE [26]. 2. Оптимизация систем культивирования клонов ex vivo. Недавно Becker и др. разработали стратегию экспансии одиночных HSCs, заменив поливиниловый спирт на Soluplus, амфифильный сополимер трансплантата полиэтиленгликоля поливинилкапролактама-ацетата (PCL-PVAc-PEG). Исследователи подсчитали, что одна экспансия HSCs с использованием Soluplus может быть усилена более чем в 33 000 раз, и в ключевых генах расширенных клонов HSCs не было обнаружено несинонимичных мутаций. Эффективность этой платформы экспансии ex vivo была продемонстрирована на модели иммунодефицита Prkdcscid, что открывает перспективы генотерапии HSCs ex vivo [110].
Conclusions
Терапия с редактированием оснований, основанная на HSCs, дала новую надежду пациентам с гематологическими заболеваниями, поскольку точность этих методов лечения начинается с корня генных мутаций. Эта новая терапия основывается на текущих разработках различных редакторов оснований. Несмотря на огромный потенциал технологии редактирования оснований, этот новый терапевтический подход все еще требует значительного развития, чтобы перейти из лаборатории в клинику. С разработкой CGBE, GBE, AYBE и AXBE были реализованы все 12 замен оснований, включая переходы и трансверсии. Другими словами, редакторы оснований могут осуществлять замены между любыми двумя основаниями [12, 13, 39, 111]. Однако для трансверсионных редакторов одновременная реализация двух типов замен оснований снижает их избирательность и ценность для клинического применения. По сравнению с базовыми редакторами, PEs могут выполнять все 12 замен оснований, а также более разнообразное редактирование генов, однако их эффективность редактирования может быть не столь высокой, как у редакторов оснований [14]. Кроме того, точность и эффективность редактирования оснований могут быть улучшены, а дизайн систем редактирования может быть оптимизирован с помощью глубокого обучения, машинного обучения и других технологий искусственного интеллекта [112]. Выбор редактора оснований имеет решающее значение для характеристики различных мутаций при различных заболеваниях. В настоящее время разработано несколько методов редактирования оснований, основанных на глубоком обучении, а также сайты предсказания внецелевого воздействия, и исследователи могут обратиться к эффективности редактирования оснований и эффективности вне-целевого воздействия, предсказанной этими сайтами, чтобы выбрать подходящие редакторы оснований, что позволит эффективно повысить эффективность экспериментов [113-115]. В настоящее время терапия редактирования оснований, направленная на HSCs, выходит на стадию клинических испытаний. Например, препарат Beam-101, разработанный компанией Beam Therapeutics, лечит SCD и β-талассемию путем стимулирования экспрессии HbF и уже вступил в I фазу клинических испытаний [4]. Несмотря на то что эти методы лечения с редактированием оснований показали потенциальную эффективность, их безопасность нуждается в дальнейшем изучении и подтверждении, поскольку они все еще находятся на ранних стадиях исследований. Поскольку исследователи все больше внимания уделяют вопросам безопасности и биоэтики в области генной терапии, мы ожидаем, что в будущем все большее число технологий редактирования оснований, опосредованных генотерапией HSCs, приведет к прорыву.
|

 рис. 1
Редактирование генов с помощью системы CRISPR/Cas с использованием четырех вариантов Cas. a Редактирование генов с помощью системы CRISPR/Cas9 для манипулирования генами через различные пути репарации ДНК. b Введение одиночной мутации D10A в структурном домене RuvC Cas9 для получения никаза Cas9 (nCas9 (D10A)). c Введение одиночной мутации HB40A в структурный домен HNH Cas9 для получения nCas9 (H840A). d Введение двойных мутаций D10A и HB40A в структурных доменах RuvC и HNH Cas9, соответственно, для получения каталитически мертвого Cas9 (dCas9). e Введение одиночных мутаций D917A или E1006A в структурном домене RuvC Cas12a для получения dCas12a
рис. 1
Редактирование генов с помощью системы CRISPR/Cas с использованием четырех вариантов Cas. a Редактирование генов с помощью системы CRISPR/Cas9 для манипулирования генами через различные пути репарации ДНК. b Введение одиночной мутации D10A в структурном домене RuvC Cas9 для получения никаза Cas9 (nCas9 (D10A)). c Введение одиночной мутации HB40A в структурный домен HNH Cas9 для получения nCas9 (H840A). d Введение двойных мутаций D10A и HB40A в структурных доменах RuvC и HNH Cas9, соответственно, для получения каталитически мертвого Cas9 (dCas9). e Введение одиночных мутаций D917A или E1006A в структурном домене RuvC Cas12a для получения dCas12a
 figure 2
Overview of different base editors. a BE3 is capable of the C-G to T-A transition. GBE is capable of C-G to G-C transversion. ABE8e is capable of the A-T to G-C transition. AYBE is capable of A-T to C-G transversion. b Mechanisms of action of BE3, GBE, ABE8e and AYBE. For both BE3 and GBE, the cytidine deaminase rAPOBEC1 enables the deamination of G-C to G-U. Then, the DNA undergoes G-U to A-U mismatch repair since UGI of BE3 inhibits UNG activity. Finally, in DNA repair or replication, T replaces U to realize the desired C-G to T-A transition. In contrast, after deamination, the UNG contained in GBE can excise U to form AP sites, which can lead to a variety of base pairing events, resulting in the desired C-G to G-C transversion in subsequent DNA repair or replication. For ABE8e and AYBE, the adenine deaminase TadA-8e enables the deamination of T-A to T-I. Then, the DNA undergoes T-I to C-I mismatch repair. Finally, in DNA repair or replication, G replaces I to realize the desired A-T to G-C transition. Above is the mechanism of ABE8e. AYBE, on the other hand, contains an MPG that can excise I to form AP sites after deamination, which can lead to a variety of base pairing events, resulting in the desired A-T to C-G and A-T to T-A transversions in subsequent DNA repair or replication
figure 2
Overview of different base editors. a BE3 is capable of the C-G to T-A transition. GBE is capable of C-G to G-C transversion. ABE8e is capable of the A-T to G-C transition. AYBE is capable of A-T to C-G transversion. b Mechanisms of action of BE3, GBE, ABE8e and AYBE. For both BE3 and GBE, the cytidine deaminase rAPOBEC1 enables the deamination of G-C to G-U. Then, the DNA undergoes G-U to A-U mismatch repair since UGI of BE3 inhibits UNG activity. Finally, in DNA repair or replication, T replaces U to realize the desired C-G to T-A transition. In contrast, after deamination, the UNG contained in GBE can excise U to form AP sites, which can lead to a variety of base pairing events, resulting in the desired C-G to G-C transversion in subsequent DNA repair or replication. For ABE8e and AYBE, the adenine deaminase TadA-8e enables the deamination of T-A to T-I. Then, the DNA undergoes T-I to C-I mismatch repair. Finally, in DNA repair or replication, G replaces I to realize the desired A-T to G-C transition. Above is the mechanism of ABE8e. AYBE, on the other hand, contains an MPG that can excise I to form AP sites after deamination, which can lead to a variety of base pairing events, resulting in the desired A-T to C-G and A-T to T-A transversions in subsequent DNA repair or replication
 figure 3
Experimental base editor-based gene therapy for hematopoietic stem cells. a Ex vivo base editing. First, HSPCs from the SCD mouse model were extracted, and ABE8e mRNA and sgRNA were subsequently introduced into unedited HSPCs by electroporation. Second, the edited HSPCs and the unedited HSPCs were transplanted into two groups of C57BL/6 mice. Finally, after 16 weeks, most of the erythrocytes in the mice transplanted with the edited HSPCs returned to normal, while most of the erythrocytes in the mice transplanted with the unedited HSPCs were sickle cells. b In vivo base editing. The vector delivering the base editor was introduced into the SCD mouse model by intravenous injection. The delivery routes included transfection of HSCs with HDAd5/35++ vectors and targeting of LNPs to CD117 on the surface of HSCs with an anti-CD117 antibody. A preponderance of normal erythrocytes was observed in blood extracted after 16 weeks. Created with BioRender.com
figure 3
Experimental base editor-based gene therapy for hematopoietic stem cells. a Ex vivo base editing. First, HSPCs from the SCD mouse model were extracted, and ABE8e mRNA and sgRNA were subsequently introduced into unedited HSPCs by electroporation. Second, the edited HSPCs and the unedited HSPCs were transplanted into two groups of C57BL/6 mice. Finally, after 16 weeks, most of the erythrocytes in the mice transplanted with the edited HSPCs returned to normal, while most of the erythrocytes in the mice transplanted with the unedited HSPCs were sickle cells. b In vivo base editing. The vector delivering the base editor was introduced into the SCD mouse model by intravenous injection. The delivery routes included transfection of HSCs with HDAd5/35++ vectors and targeting of LNPs to CD117 on the surface of HSCs with an anti-CD117 antibody. A preponderance of normal erythrocytes was observed in blood extracted after 16 weeks. Created with BioRender.com