Ползователи: 
CRISPR
Модификации направляющих РНК (gRNA)
Selection of extended CRISPR RNAs with enhanced targeting and specificity Ashley Herring-Nicholas, Hillary Dimig, Miranda R. Roesing et al.
 Communications Biology volume 7, Article number: 86 (2024)
|
As CRISPR effectors like Cas9 increasingly enter clinical trials for therapeutic gene editing, a future for personalized medicine will require efficient methods to protect individuals from the potential of off-target mutations that may also occur at specific sequences in their genomes that are similar to the therapeutic target. A Cas9 enzyme’s ability to recognize their targets (and off-targets) are determined by the sequence of their RNA-cofactors (their guide RNAs or gRNAs). Here, we present a method to screen hundreds of thousands of gRNA variants with short, randomized 5’ nucleotide extensions near its DNA-targeting segment—a modification that can increase gene editing specificity by orders of magnitude—to identify extended gRNAs (x-gRNAs) that effectively block any activity at those off-target sites while still maintaining strong activity at their intended targets. X-gRNAs that have been selected for specific target / off-target pairs can significantly out-perform other methods that reduce Cas9 off-target activity overall, like using Cas9 variants engineered for higher specificity in general, and we demonstrate their effectiveness in clinically-relevant gRNAs. Our streamlined approach to efficiently identify highly specific and active x-gRNAs provides a way to move beyond a one-size-fits-all model of high-fidelity CRISPR for safer and more effective personalized gene therapies.

|
CRISPR-эффектор Cas9 из Streptococcus pyogenes (SpyCas9) за последние несколько лет превратился в мощный биотехнологический инструмент, который также обладает огромным терапевтическим потенциалом в лечении генетических заболеваний, в том числе нескольких, которые уже прошли клинические испытания1,2. Этот потенциал обусловлен способностью эффекторов CRISPR использовать модульный сегмент своего РНК-кофактора ( guide RNA или gRNA) для распознавания последовательностей ДНК, комплементарных ее сегменту, нацеленному на ДНК (так называемому "спейсеру"), и вносить целевые мутации в ДНК в этих местах3,4. Однако часто gRNA для конкретной цели может привести к тому, что нуклеаза Cas9 будет вносить не-целевые двунитевые разрывы (DSBs) и мутации в аналогичные нуклеотидные последовательности, которые также присутствуют в других местах генома5,6. Возможность непреднамеренных мутационных событий, вызванных Cas9, вызывает серьезные опасения при терапевтическом применении. Сложность предотвращения таких мутаций вне мишени заключается в том, что геном человека велик, эффекторы Cas9 толерантны к небольшим различиям между предполагаемой мишенью и другими участками, которые могут присутствовать в геноме человека7 , а существование таких участков вне мишени в ДНК пациента может быть даже не известно или не обнаружено априори. В частности, становится все более важным признать, что люди несут уникальные или персональные вне-целевые последовательности для терапевтической gRNA в результате генетических вариаций, существующих между людьми и/или в разных популяциях, и что эти уникальные вне-целевые последовательности должны быть учтены в эпоху персонализированной медицины8,9.
Существует несколько способов уменьшить вне-целевую активность Cas9 в целом и повысить специфичность CRISPR-систем в целом. Например, эти общие подходы включают снижение воздействия нуклеазы Cas9 на клетки10 или селективное ингибирование активности нуклеазы Cas9 вообще11 , а также использование модифицированных вариантов Cas9 с высокой точностью (или повышенной специфичностью), таких как eCas912. Эффекторы eCas9 имеют аминокислотные замены, направленные на снижение их общего сродства к ДНК, чтобы уменьшить как вероятность активации латентных нуклеазных доменов эффекторов на последовательностях с несовершенной комплементарностью к его gRNA13 , так и их общую активность14. Также было обнаружено, что модификация самой gRNA может изменять специфичность Cas9; gRNA с химически модифицированными основаниями, фосфатами или сахарами могут демонстрировать повышенную специфичность по сравнению с не-модифицированными gRNA, хотя оптимальное сочетание модификаций для конкретной цели и эффектов вне мишени трудно предсказать de novo15,16. Удаление нескольких нуклеотидов с 5' конца спейсера gRNA (с 20 нт до 17-18 нт) для создания усеченных gRNA (tru-gRNA) также может снижать вне-целевую активность17, эффект, вероятно, вызван общей дестабилизацией взаимодействий gRNA и ДНК при укорачивании спейсеров13. Существуют и другие подходы, пытающиеся "замаскировать" потенциальные вне-целевые участки с помощью совместной трансфекции дополнительных компонентов CRISPR и/или gRNA18,19.
Недавно было обнаружено, что добавление коротких нуклеотидных удлинений (от ~6 до ~16 нт) к 5'-концу спейсера gRNA (рис. 1) - особенно тех, которые, как было предсказано, образуют "шпильки" или вторичные структуры со спейсером, предназначенные для вмешательства во взаимодействие gRNA в специфические off-target последовательности - может значительно снизить off-target активность Cas9 при сохранении on-target мутационной эффективности 20. В среднем специфичность нацеливания при редактировании генов для этих вариантов gRNA, названных hairpin-gRNAs (hp-gRNAs), увеличивалась в 50 раз (и до 200 раз) по сравнению с редактированием генов с помощью стандартных gRNA, и этот подход работал в различных эффекторах CRISPR для нескольких целевых сайтов каждый. Хотя эти hp-gRNAs могли значительно превзойти другие существующие gRNAs, 5' удлиненные последовательности были разработаны и протестированы по одной вручную для каждой целевой последовательности и набора вне-целевых участков. В то время было также обнаружено, что некоторые из протестированных 5'-удлинений не снижали эффективную активность вне мишени, другие значительно подавляли активность на мишени, а третьи, которые не должны были повышать специфичность (контрольные), иногда повышали ее. Поскольку существует очень большое количество возможных коротких 5'-расширений и, в принципе, различные 5'-расширения для одной и той же последовательности спейсера могут быть точно настроены или оптимизированы для ограничения активности в отношении конкретных последовательностей off-target, невозможность предсказать de novo, какие из этих последовательностей повысят специфичность связанного с Cas9/gRNA рибонуклеопротеина (RNP), ограничивает их применение на практике для устранения риска мутации off-target во время редактирования генов.
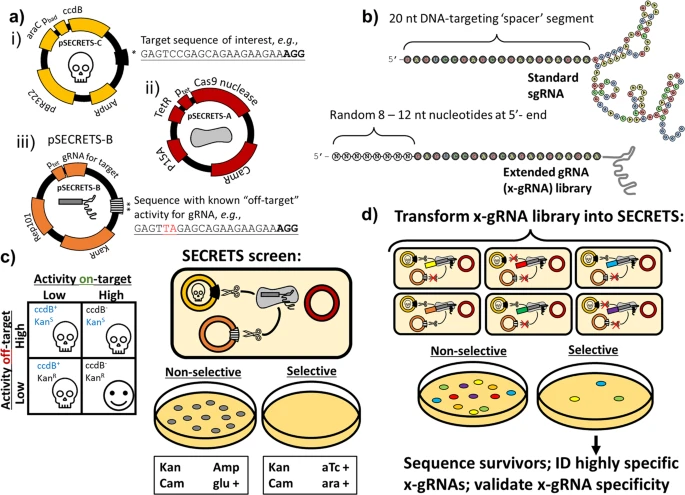 Fig. 1: SECRETS screen to identify short 5’-nucleotide extensions to gRNAs that increase Cas9 gene editing specificity for a given target with known off-targets.
a Simplified schematics of the three SECRETS plasmids: (i) high-copy number plasmid with inducible toxin and target sequence of interest to select for on-target activity, (ii) medium copy plasmid for inducible expression of Cas9, and (iii) low-copy plasmid for gRNA expression and counterselection for off-target activity with kanamycin resistance cassette and a known off-target sequence for the gRNA. b (above) a standard gRNA has 20 nt DNA-targeting segment known as a spacer while (below) an extended gRNA (x-gRNA) has an additional 8–12 nt to the 5’- of the spacer. c During SECRETS selection, E. coli expressing standard gRNAs that exhibit promiscuous activity are unable to survive. d Members of large, randomized x-gRNA libraries can be screened simultaneously using SECRETS for 5’-extensions that result in efficient on-target Cas9 activity and minimized off-target activity that can be used for highly specific gene editing applications at that target.
Чтобы преодолеть эту проблему, мы представляем экспериментальный протокол для одновременного скрининга от десятков до сотен тысяч последовательностей-кандидатов 5'-расширений с целью эффективного и надежного выявления новых расширенных последовательностей gRNA (x-gRNA), которые сохраняют устойчивую активность Cas9 в мишени и при этом значительно повышают специфичность редактирования генов, эффективно устраняя его активность на известных внемишенных последовательностях, где традиционные подходы к повышению общей специфичности Cas9 могут не сработать (рис. 1). В этом протоколе, названном Selection of Extended CRISPR RNAs with Enhanced Targeting and Specificity (SECRETS), активность ферментов Cas9 с библиотекой кандидатов x-gRNA оценивается параллельно с использованием системы на основе кишечной палочки, которая сильно селективна по способности стимулировать активность нуклеазы Cas9 на мишени и контрселективна по активности на своих off-мишенях. Мы обнаружили, что х-gRNA, созданные с помощью SECRETS для конкретных пар "цель/последовательность вне мишени", могут значительно превзойти другие методы, снижающие активность Cas9 вне мишени в целом, например, использование вариантов Cas9, которые были сконструированы для более высокой специфичности в целом для нескольких высокоактивных и клинически значимых gRNA. Наш оптимизированный подход к эффективному определению высокоспецифичных и активных х-gRNA позволяет выйти за рамки универсальной модели высокоточного CRISPR для создания более безопасных и эффективных персонализированных генных терапий.
Results and discussion
The SECRETS protocol to efficiently identify high-activity and high-specificity extended gRNA (x-gRNA) variants
Для проведения SECRETS готовится штамм E. coli для размножения трех плазмид (рис. 1а): (i) плазмида с высокой копийностью экспрессирует токсин ccdB в присутствии арабинозы (ara), а также содержит интересующую целевую последовательность; (ii) плазмида со средней копийностью экспрессирует Cas9 в присутствии ангидротетрациклина (aTc) и обеспечивает устойчивость к хлорамфениколу; и (iii) плазмида с низкой копийностью экспрессирует библиотеку х-gRNA (рис. 1b), обеспечивает устойчивость к антибиотику канамицину (KanR), а также содержит известную последовательность off-target для gRNA. DSBs, индуцированные Cas9 в интересующей мишени в E. coli, приводят к деградации плазмиды ccdB, позволяя бактериям выживать в присутствии арабинозы, в то время как DSBs, индуцированные Cas9 в известной off-target активностью, приводят к деградации плазмиды gRNA и восприимчивости бактерий к антибиотику канамицину (KanS) 21... Только те gRNA, которые проявляют сильную активность в предполагаемых мишенях и низкую активность в сайтах вне мишеней, выдерживают отбор SECRETS (рис. 1c) 23.
SECRETS определяет оптимизированные х-gRNA для различных пар "цель/не-цель".
Мы протестировали эту систему с хорошо изученной gRNA 20 для человеческого гена EMX1 против его целевой последовательности (EMX1 ON) и другой последовательности в геноме человека, где комплекс Cas9/gRNA RNP, как известно, проявляет off-target активность (EMX1 OFF1) из-за двухнуклеотидного различия в позициях, где эффекторы Cas9 особенно чувствительны к расхождениям последовательностей (рис. 1а) 24. После экспрессии Cas9/gRNA в течение 1 ч с последующим посевом и ночным ростом на LB с aTc, арабинозой, хлорамфениколом (cam) и канамицином мы обнаружили сильное подавление роста E. coli стандартной gRNA EMX1, но только когда последовательность EMX1 OFF1 присутствует в канамицин-устойчивой плазмиде (рис. S1)... Эти пять х-gRNA, идентифицированные с помощью протокола SECRETS, также продемонстрировали более высокий уровень специфичности в целом, устраняя внецелевую активность Cas9 в трех других известных внецелевых последовательностях EMX1 (EMX1 OFF2 - OFF4, содержащих 2-4 различия с последовательностью EMX1 ON) и снижая активность нуклеазы во всех четырех вне-целевых последовательностях еще больше по сравнению с eCas9 со стандартной gRNA (рис. 3а и S2)...
 Fig. 2: Next-generation sequencing following SECRETS screens reveals candidate x-gRNAs for EMX1 with high activity and specificity.
The average fraction of next-generation sequencing (NGS) reads from two SECRETS replicates reveals several standout x-gRNAs from E. coli that survived (Ex1-5). These top 5 (red dots) were subsequently evaluated for subsequent in vitro validation...
Чтобы подтвердить, что х-gRNA, идентифицированные с помощью SECRETS, будут оставаться активными в клеточных линиях человека для редактирования генома, мы трансфицировали RNP-комплексы с вариантами Cas9 (Cas9 дикого типа, каталитически неактивный dCas94; или сконструированный с повышенной специфичностью eCas912) и вариантами gRNA (стандартные gRNA или x-gRNA) в эпителиальные клетки легких человека A549, а затем провели анализы обнаружения мутаций T7E1 и секвенирование следующего поколения (NGS) для количественного определения частоты мутаций в мишени EMX1. Cas9 RNPs с x-gRNA, идентифицированные с помощью SECRETS, продемонстрировали надежное редактирование генома в клетках A549 и более высокую частоту мутаций на мишени, чем eCas9 (рис. 3c). Хотя ранее сообщалось, что расширение gRNA за пределы сегмента спейсера, используемого для распознавания ДНК и нацеливания, не приводит к появлению новых вне-целевых мишеней20 - вероятно, потому, что 20 нт сегменты нацеливания gRNA остаются неизменными, - мы также провели тест на вне-целевую нуклеазную активность (CHANGE-seq5) в масштабах всего генома. Как и ожидалось, мы обнаружили значительное снижение активности внецелевого расщепления по всему геному и отсутствие новых вне-целевых мишеней (рис. 3б). Таким образом, эти результаты свидетельствуют о том, что протокол SECRETS позволяет надежно идентифицировать несколько высокоэффективных кандидатов х-gRNA с большим потенциалом для специфического редактирования генов в клетках человека, которые устраняют off-target активность в выбранных локусах.
SECRETS identifies optimized x-gRNAs for therapeutically relevant targets
Учитывая эти результаты, мы попытались определить, можно ли применить протокол SECRETS к gRNA с потенциальным терапевтическим применением, таким как одна из них, которая в настоящее время используется в клинических испытаниях для лечения sickle-cell disease (SCD) (Walters, M. (2024-06-01 (Est.) - 2028-06-01 (Est.)). Проводилась трансплантация модифицированных гемопоэтических стволовых клеток и предшественников (CRISPR_SCD001), содержащих кластеризованные регулярные короткие палиндромные повторы, пациентам с тяжелой серповидноклеточной болезнью. Identifier NCT04774536. https://clinicaltrials.gov/study/NCT04774536). Эта конкретная gRNA25,26 нацелена на ген HBB для гомологически направленной коррекции варианта SCD, но также сообщалось о значительном уровне активности off-target, это мы также наблюдали in vitro. В данном случае off-target отличается от мишени на 3 нуклеотида, которые образуют базовую пару с крайним 5'-концом gRNA (рис. 5) - позицией, где РНК Cas9 наиболее устойчивы к несоответствиям, и позицией, где другие методы, такие как усечение 5'-конца gRNA17 , могли бы улучшить специфичность. Мы провели скрининг SECRETS, а затем протестировали три лучшие х-gRNA in vitro (Дополнительные данные 3), и обнаружили, что они действительно значительно снижают активность на вне-целевой последовательности, сохраняя при этом активность на целевой последовательности стандартной gRNA (рис. 5а). Это свидетельствует о том, что протокол SECRETS может быть применен к терапевтически значимым gRNA и потенциально сделать их более безопасными, значительно снизив риск мутаций вне мишени.
Fig. 5: SECRETS is effective at identifying highly specific x-gRNAs for clinically relevant gRNAs...
Further development of the SECRETS protocol
В описанных выше демонстрациях мы проверили рандомизированные библиотеки х-gRNA из 65 336 вариантов (N8) в протоколе SECRETS для каждой gRNA-мишени. Мы также выявили улучшенные х-gRNA из более сложных исходных библиотек (250 000 + 5'- вариантов удлиняющих последовательностей), включая объединенные библиотеки вариантов N8, содержащих различные дополнительные 4 нт мотивы tetraloop20 (N8+4), призванные способствовать взаимодействию между сегментом N8 и ДНК-мишенью х-gRNA (рис. S4). Действительно, мы отмечаем, что "пространство" потенциальных последовательностей 5'-расширения для х-gRNA довольно велико20 (рис. S4A) - мы ожидаем, что большие библиотеки х-gRNA из 410 или 412 (1-16 M) вариантов могут быть легко сгенерированы и проверены в E. coli для поиска новых интересующих пар мишеней/не-мишеней. Полученные результаты позволяют предположить, что это пространство также достаточно богато высокоэффективными вариантами gRNA, поскольку в ходе относительно небольшого скрининга SECRETS мы смогли идентифицировать несколько gRNA для нескольких спейсерных последовательностей, которые демонстрировали исключительные профили активности и специфичности. Кроме того, х-gRNA смогли улучшить специфичность различных эффекторов CRISPR, включая Cas9 из Staphylococcus aureus и различные эффекторы Cas1220 , поэтому протокол SECRETS может быть легко адаптирован и для этих систем (рис. S4A).
Conclusions
Для многих биотехнологических или терапевтических применений часто желательно нацелить Cas9/gRNA RNP на конкретную нуклеотидную мишень, представляющую интерес (например, когда нет гибкости в выборе близлежащих сайтов). Если установлено, что существует вероятность вне-целевой активности на определенных участках в образце или у пациента, возможности минимизации активности на этих конкретных вне-целевых участках могут быть ограничены. Здесь мы демонстрируем, что протокол SECRETS может быть использован для надежной идентификации сверх-специфических вариантов для интересующих нас gRNA и клинически значимых gRNA, которые были явно отобраны а противовес активности в этих вне-целевых сайтах. Этот подход может быть использован для надежной генерации х-gRNA без использования дизайна, что фактически устраняет необходимость в индивидуальной оптимизации, и был экспериментально оптимизирован для простоты путем клонирования новых пар "цель/не-цель" по требованию в скрининговые плазмиды для облегчения быстрого отбора улучшенных х-gRNA. После определения потенциальных вне-целевых сайтов скрининг SECRETS обеспечивает доступный и надежный метод идентификации высокоэффективных вариантов х-gRNA для конкретных мишеней, представляющих интерес (рис. 5b). Мы ожидаем, что дальнейший вывод и развитие этого подхода позволит более безопасно применять передовые подходы к редактированию генов CRISPR, требующие gRNA с высокой специфичностью, такие как SNP-таргетинг и/или аллель-специфическое редактирование генов. По мере того как подходы к предсказанию и выявлению новых вне-целевых последовательностей у отдельных пациентов становятся все более сложными и рутинными5,8, мы ожидаем, что методы, подобные SECRETS, которые могут надежно и быстро генерировать высоко-специфичные и высокоактивные варианты gRNA, эффективно устраняющие активность Cas9 на конкретных вне-целевых участках, будут приобретать все большее значение в приложениях генотерапии и персонализированной медицины.
|
 Fig. 1: SECRETS screen to identify short 5’-nucleotide extensions to gRNAs that increase Cas9 gene editing specificity for a given target with known off-targets.
a Simplified schematics of the three SECRETS plasmids: (i) high-copy number plasmid with inducible toxin and target sequence of interest to select for on-target activity, (ii) medium copy plasmid for inducible expression of Cas9, and (iii) low-copy plasmid for gRNA expression and counterselection for off-target activity with kanamycin resistance cassette and a known off-target sequence for the gRNA. b (above) a standard gRNA has 20 nt DNA-targeting segment known as a spacer while (below) an extended gRNA (x-gRNA) has an additional 8–12 nt to the 5’- of the spacer. c During SECRETS selection, E. coli expressing standard gRNAs that exhibit promiscuous activity are unable to survive. d Members of large, randomized x-gRNA libraries can be screened simultaneously using SECRETS for 5’-extensions that result in efficient on-target Cas9 activity and minimized off-target activity that can be used for highly specific gene editing applications at that target.
Fig. 1: SECRETS screen to identify short 5’-nucleotide extensions to gRNAs that increase Cas9 gene editing specificity for a given target with known off-targets.
a Simplified schematics of the three SECRETS plasmids: (i) high-copy number plasmid with inducible toxin and target sequence of interest to select for on-target activity, (ii) medium copy plasmid for inducible expression of Cas9, and (iii) low-copy plasmid for gRNA expression and counterselection for off-target activity with kanamycin resistance cassette and a known off-target sequence for the gRNA. b (above) a standard gRNA has 20 nt DNA-targeting segment known as a spacer while (below) an extended gRNA (x-gRNA) has an additional 8–12 nt to the 5’- of the spacer. c During SECRETS selection, E. coli expressing standard gRNAs that exhibit promiscuous activity are unable to survive. d Members of large, randomized x-gRNA libraries can be screened simultaneously using SECRETS for 5’-extensions that result in efficient on-target Cas9 activity and minimized off-target activity that can be used for highly specific gene editing applications at that target.
 Fig. 2: Next-generation sequencing following SECRETS screens reveals candidate x-gRNAs for EMX1 with high activity and specificity.
The average fraction of next-generation sequencing (NGS) reads from two SECRETS replicates reveals several standout x-gRNAs from E. coli that survived (Ex1-5). These top 5 (red dots) were subsequently evaluated for subsequent in vitro validation...
Fig. 2: Next-generation sequencing following SECRETS screens reveals candidate x-gRNAs for EMX1 with high activity and specificity.
The average fraction of next-generation sequencing (NGS) reads from two SECRETS replicates reveals several standout x-gRNAs from E. coli that survived (Ex1-5). These top 5 (red dots) were subsequently evaluated for subsequent in vitro validation...