Psoriasis vulgaris - наиболее распространенное клиническое проявление псориаза, поражающее около 90 % больных псориазом. Psoriasis vulgaris - это длительное и неинфекционное заболевание, характеризующееся болью, обезображиванием и инвалидностью. Это заболевание поражает примерно 2-3 % населения планеты, проявляясь в виде красных, огрубевших, чешуйчатых пятен на коже, а также может поражать ногти и суставы.1 Это заболевание может встречаться у представителей любого пола в любом возрасте.2 Недавнее исследование показало, что случаи появления нового псориаза или обострения существующего псориаза наблюдались в качестве кожных побочных явлений после вакцинации COVID-19. Поэтому пациентам с псориазом может потребоваться частое наблюдение до и после вакцинации COVID-19.3 В зависимости от типа и тяжести псориаза, методы лечения могут применяться как отдельно, так и в сочетании друг с другом. Однако основная проблема имеющихся в настоящее время методов лечения заключается в том, что большинство из них связаны с побочными эффектами при пероральном или внутривенном введении.4 В клинической практике для лечения псориаза обычно используется разнообразный набор терапевтических подходов. Для лечения псориаза средней и тяжелой степени тяжести используется целый ряд терапевтических методов, включая топические препараты, такие как гели и кремы, фототерапию, системные препараты и биопрепараты.5 Учитывая изменения характеристик кожи, вызванные псориазом, и неблагоприятные эффекты, связанные с системными пероральными и биологическими препаратами, срочно требуется поиск инновационных подходов к лечению псориаза. В результате рассматриваются инновационные стратегии лечения, использующие генотерапию, такие как антисмысловые нуклеотиды, комплексы РНК-глушителей, терапия стволовыми клетками и терапия на основе антител. Несмотря на то, что генотерапия в настоящее время не применяется в качестве лечения псориаза, все большее число исследований изучает генетические основы псориаза.6 Несмотря на значительные инвестиции в разработку лекарств, процент успеха препаратов в клинических испытаниях остается относительно низким. Использование животных моделей в доклинических исследованиях играет ключевую роль в преодолении разрыва между до-клиническим и клиническим этапами, но этот процесс может быть сложным из-за наличия несовершенных исследований. Выбор валидированной и прогностической модели животного очень важен для точного решения клинических вопросов.7
За последние три десятилетия животные модели псориаза становятся все более распространенными в доклинических исследованиях, причем каждая модель имеет свои преимущества и недостатки. Некоторые модели демонстрируют большее сходство с человеческой болезнью, в то время как другие дают бесценную информацию о глубинных механизмах патогенеза псориаза.8 Получить представление о патофизиологии псориаза может быть сложно в лабораторных условиях, поскольку у животных это заболевание не развивается естественным образом. Однако с помощью различных методов, таких как трансгенез, нокаут, ксенотрансплантация, иммунологическое восстановление, введение лекарств или спонтанная мутация, были созданы различные модели грызунов, позволяющие пролить свет на специфические аспекты сложной иммуно-опосредованной патологии псориаза.9
Использование животных моделей, имитирующих псориаз, привело к важным открытиям в области механизмов, лежащих в основе хронических воспалительных заболеваний, и сыграло решающую роль в разработке многих эффективных современных методов лечения.10-12 Благодаря использованию животных моделей, особенно мышей, исследователи получили ценные сведения о псориазе, включая эффективность различных методов лечения и сложное взаимодействие между иммунными клетками и медиаторами воспаления. В связи с этим количество научных работ, посвященных животным моделям псориаза, неуклонно растет. Несмотря на эту тенденцию, удивительно, что за последние пять десятилетий использования животных моделей для подобных исследований не было стандартизированной экспериментальной характеристики этих моделей.9 Различные доклинические исследования на животных моделях способствовали нескольким клиническим достижениям благодаря выяснению роли конкретных иммунных клеток и их факторов, а также раскрытию клеточных и молекулярных механизмов, лежащих в основе взаимодействия между иммунными клетками и кератиноцитами, которые способствуют развитию псориазиформного воспаления кожи.8
Widely Applied Mouse Models of Psoriasis
В последние десятилетия в многочисленных научных работах изучались различные животные модели для изучения псориаза. Эти модели значительно расширили наше понимание патомеханизмов, лежащих в основе хронического воспаления при псориазе. Однако они также выявили ряд сохраняющихся проблем. С появлением новых генетических, клеточных и молекулярных представлений о патогенезе псориаза у человека значительно возросло число инновационных доклинических мышиных моделей, имитирующих псориаз.7 В нашем исследовании мы отнесли каждую модель псориаза к одному из пяти различных типов: модели ксенотрансплантации, трансгенные и нокаутные модели, модели с избыточной экспрессией IL-23 и модели с местным применением имиквимода (IMQ).
Xenotransplantation Models
Модели ксенотрансплантации предполагают пересадку псориатической кожи человека иммунодефицитным мышам. Пересаженная человеческая кожа сохраняет характеристики псориаза, обеспечивая платформу для изучения иммунного ответа человека и патогенеза псориаза. Эти модели очень похожи на человеческий псориаз и ценны для изучения иммунного ответа и тестирования потенциальных методов лечения. Однако они могут быть более сложными, трудоемкими и дорогостоящими по сравнению с другими моделями.13,14
Transgenic and Knockout Mouse Models
Трансгенные мыши генетически модифицированы для экспрессии генов, связанных с патогенезом псориаза, а у нокаутных мышей отсутствуют определенные гены, имеющие отношение к псориазу. Эти модели облегчают изучение роли конкретных генов в развитии и прогрессировании псориаза. Они дают представление о генетических основах псориаза и полезны для изучения молекулярных путей. Важно отметить, что эти модели могут не полностью отражать сложную, многофакторную природу псориаза у человека. Ha и др. использовали мышей с дефицитом IL-20RB (IL-20RB KO), у которых отсутствуют рецепторы IL-20, для изучения роли этих цитокиновых рецепторов в развитии псориаза.15
Spontaneous Mutation Models
Спонтанные мутации у мышей изначально послужили первыми животными моделями, в которых специфический генетический фон и аллельные мутации приводили к развитию псориаз-подобного дерматита. Эти мутации естественным образом проявляются у мышей, приводя к фенотипу, имитирующему определенные аспекты псориаза. Примером таких спонтанных мутаций являются Asebia, хронический пролиферативный дерматит, чешуйчатый хвост и шелушащаяся кожа мышей. Однако их реакция на антипсориатическую терапию, такую как системный этретинат или циклоспорин, была неадекватной. С появлением генетических и иммунологических манипуляций эти модели спонтанных мутаций, часто демонстрирующие сложные патологические изменения в различных системах органов, постепенно отходят на второй план в исследованиях псориаза.16
IL-23-Overexpressing Models
Модели со сверхэкспрессией IL-23 предполагают создание у мышей повышенного уровня интерлейкина-23 (IL-23), ключевого цитокина, связанного с патогенезом псориаза. Это приводит к иммунным реакциям и воспалению кожи, которые имитируют псориаз. Эти модели фокусируются на конкретном пути и цитокине, связанном с псориазом, но не могут в полной мере отражать сложную природу заболевания, в котором участвуют многочисленные цитокины и сигнальные пути.17,18
Imiquimod (IMQ) Application Model
Мышиная модель псориаза IMQ широко используется для изучения псориаз-подобного воспаления кожи у мышей. Она основана на местном применении IMQ, агониста toll-like receptor (TLR)7/8, чтобы вызвать воспаление кожи. Использование модели IMQ обеспечивает высокий уровень воспроизводимости, быстрое развитие болезни и способность имитировать иммунные реакции человека, что способствует изучению иммунологических аспектов. Эту модель можно легко масштабировать. Дозу и продолжительность можно легко регулировать, а генетическая модификация часто не требуется. Она оказывается экономически эффективной и не-инвазивной, что способствует эффективному изучению механизмов псориаза и потенциальных методов лечения. Следовательно, эта модель служит общей отправной точкой для исследований, побуждая к проведению дополнительных исследований. Хотя эта модель имеет некоторые общие черты с человеческим псориазом, она также имеет ограничения, о которых исследователи должны знать. Модель IMQ имеет недостатки для тщательного изучения псориаза. Она воздействует преимущественно на кожу, исключая системное поражение и ограничивая изучение воспаления суставов и системных факторов. Преходящий характер воспаления, вызванного IMQ, препятствует изучению хронического псориаза. Межиндивидуальные различия добавляют сложности к согласованности результатов. Диспропорции в иммунном ответе и генетическое единообразие инбредных мышей препятствуют применимости полученных результатов к различным человеческим популяциям. Простота модели не соответствует разнообразной природе человеческого псориаза. Возникают этические проблемы, связанные с использованием животных в исследованиях. Хотя модель мыши IMQ дает ценные сведения о специфических аспектах исследования псориаза, исследователи должны проявлять осторожность при применении ее результатов к человеческому псориазу. Эта модель часто используется в качестве начального этапа исследований.19,20
Эти альтернативные модели животных служат ценными ресурсами для изучения различных аспектов псориаза, будь то изучение иммунного ответа, генетических факторов или специфических цитокиновых путей. Исследователи обычно выбирают модель, которая наилучшим образом соответствует их целям исследования и конкретным аспектам псориаза, которые они намерены изучить.
The Pathogenesis and Genetics of Psoriasis
Псориаз - это аутоиммунное воспалительное заболевание с участием Т-клеток, которое обычно проявляется в виде эритемато-сквамозных бляшек с четко очерченными границами, которые могут покрывать большую площадь тела.
21 Аутоиммунное воспаление отвечает за развитие псориаза бляшечного типа, при котором активируются дермальные дендритные клетки, вырабатывающие воспалительные цитокины, такие как TNF и IL-23. Активированные CD4+ и CD8+ Т-клетки являются частью популяции воспалительных клеток, присутствующих в псориатических поражениях кожи, и они играют важную роль в прогрессировании заболевания. В частности, они способствуют гиперпролиферации кератиноцитов, вырабатывая провоспалительные цитокины, включая IFNγ, IL-17A/F, IL-22 и TNF-α.
22 Распознавание эпидермальных аутоантигенов цитокин-продуцирующими клетками Th17 инициирует эпидермальную гиперпролиферацию. Это, в свою очередь, побуждает кератиноциты вырабатывать хемокины, которые привлекают целый ряд лейкоцитов, включая Th17-клетки, дендритные клетки, макрофаги и нейтрофилы. Одновременно кератиноциты вырабатывают антимикробные пептиды для активации врожденного иммунитета и другие медиаторы воспаления, способствующие усилению воспалительного ответа. Этот каскад приводит к поддержанию воспаления и развитию псориатического фенотипа. Макрофаги играют роль в усилении воспаления при псориазе и повышении концентрации цитокинов Th1. Эти данные подчеркивают участие макрофагов в формировании и персистенции псориатических поражений.
23 Циркулирующие нейтрофилы мигрируют в псориатические поражения, где они запускают такие процессы, как дыхательный взрыв, дегрануляция и образование NETs. Эти действия способствуют иммунопатогенезу псориаза, который включает дисбаланс в ответах Т-клеток, пролиферацию кератиноцитов, ангиогенез и развитие аутоантигенов (рис. 1).
24,25 Основными факторами, способствующими развитию бляшечного псориаза, наиболее распространенного типа псориаза, являются такие цитокины, как TNF-α, IL-17 и IL-23, тогда как пустулезный псориаз, менее частая форма, связан с мутацией IL-36RN. Для лечения умеренного и тяжелого псориаза были одобрены различные биологические препараты, направленные на эти цитокины, включая те, которые направлены на TNF-α, IL-12/IL-23, IL-17 и IL-23/IL-39.
26
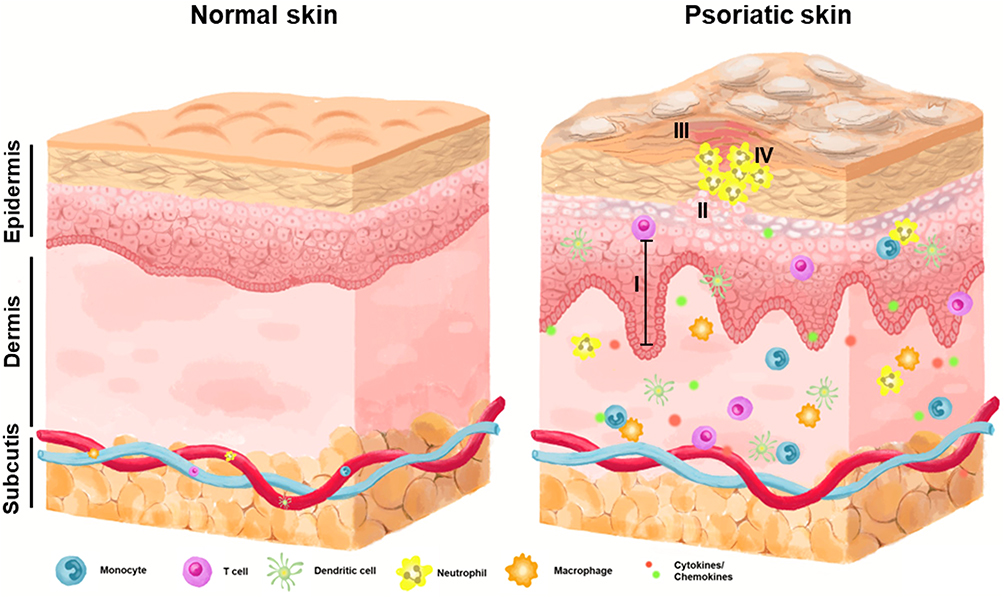
Figure 1
A simplified diagram illustrating the structural alterations in human skin affected by psoriasis. Normal skin structure (left) and compared with psoriatic skin (right). The formation of scaly, raised, red plaques on the skin, accompanied by I. acanthosis; II. parakeratosis; III. hyperkeratosis; IV. Munro’s microabscess. These plaques can be uncomfortable and itchy, causing pain and irritation.
Псориаз - сложное заболевание, на которое влияют генетические, экологические и эпигенетические факторы, воздействующие на экспрессию генов. Достижения геномики позволили выявить более 50 генетических маркеров, ассоциированных с повышенной восприимчивостью к псориазу в различных этнических популяциях, благодаря широко геномным исследованиям ассоциаций (GWAS) и платформам генотипирования.27 Некоторые из этих генов, связанных с предрасположенностью к псориазу, находятся в непосредственной близости от генов, регулирующих адаптивные и врожденные иммунные реакции, а также генов, участвующих в поддержании барьерной функции кожи. Современные исследования показали, что на патогенез псориаза влияют эпигенетические модификации, такие как модификация гистонов, метилирование промоторов и дисрегуляция длинных не-кодирующих РНК (lncRNAs) и микроРНК (miRNAs). Считается, что различные изменения в экспрессии генов и сигнальных путях, включая аномальную дифференциацию и пролиферацию кератиноцитов, нарушение коммуникации между кератиноцитами и воспалительными клетками, неоангиогенез и хроническое воспаление, способствуют развитию псориаза. Исследование Tsoi et al28 проанализировало экспрессию lncRNAs в псориатической коже и выявило 2942 ранее аннотированных и 1080 новых lncRNAs как в вовлеченных, так и в не вовлеченных участках кожи. Анализ показал, что несколько lncRNA, особенно с различными уровнями экспрессии, были совместно экспрессированы с генами, связанными с иммунитетом. Эти новые идентифицированные lncRNA были обогащены в комплексе эпидермальной дифференцировки и имели различные тканеспецифические паттерны экспрессии и эпигенетические профили, что указывает на их потенциальную роль в патогенезе псориаза. Таким образом, данные исследования Tsoi et al. свидетельствуют о том, что несколько lncRNA могут быть вовлечены в иммуно-опосредованное развитие псориаза.28,29 Некоторые циркулирующие в крови миРНК также могут служить специфическими маркерами для диагностики, прогноза и ответа на лечение псориаза. Кроме того, в ходе GWAS было выявлено множество однонуклеотидных полиморфизмов (SNPs), которые ассоциируются с повышенным риском развития псориаза, что подчеркивает участие врожденной иммунной системы в патогенезе заболевания. SNPs относятся к генам, вовлеченным в функцию и дифференцировку Т-клеток (например, ETS1, RUNX3, TNFRSF9, MBD2 и IRF4), сигнализацию интерферонов и цитокинов I типа (например, ELMO1, TYK2, SOCS1, IFIH1/MDA5, RNF114, IRF4, RIG1/DDX58 и IFNLR1/IL28RA), а также регуляцию NF-κB-ассоциированных воспалительных сигнальных путей (таких как TNFAIP3, TNIP1, TYK2, REL, NFkBIA, CARD14, CARM1, UBE2L3 и FBXL19).30-32 Псориаз связан с генетическими факторами, которые вовлекают ось IL-23/IL-17, и различные гены, вовлеченные в этот путь, включают IL23R, IL12B, IL12RB, IL23A, IL23R, TYK2, STAT3, STAT5A/B, SOCS1, ETS1, TRAF3IP2, KLF4 и IF3.33-35
Было установлено, что эпигенетические модификации, включая изменения в модификациях гистонов, метилирование промоторов и нарушения в работе lncRNAs и miRNAs, вовлечены в патогенез псориаза. Несколько не-кодирующих РНК ncRNAs) были вовлечены в патогенез псориаза. Вот некоторые важные ncRNAs и их роль в развитии псориаза:
miR-146a
miR-146a выступает в качестве негативного регулятора воспаления при псориазе. Он направлен против фактора 6, связанного с рецептором TNF (TRAF6), и киназы 1, связанной с рецептором интерлейкина-1 (IRAK1), двух ключевых компонентов сигнального пути NF-κB, тем самым ослабляя воспалительную реакцию.36
miR-146b
miR-146b - еще одна миРНК, связанная с патогенезом псориаза. Она нацелена на сигнальный путь TLR4, снижая уровень провоспалительных цитокинов и ингибируя гиперпролиферацию кератиноцитов.37
miR-203
miR-203 снижена в очагах псориаза. Она играет роль в регуляции дифференцировки кератиноцитов, и его дисрегуляция способствует изменению дифференцировки, наблюдаемому при псориазе.38
miR-21
miR-21 повышена в псориатических поражениях. Она способствует воспалению и пролиферации кератиноцитов, воздействуя на множество генов, которые негативно регулируют эти процессы, включая программируемую клеточную смерть 4 (PDCD4) и гомолог sprouty 1 (SPRY1).39
miR-31
miR-31 повышается в псориатической коже и способствует развитию кожных поражений, регулируя пролиферацию кератиноцитов и воспаление.40
Циркулярная РНК ciRS-7 (Cdr1as)
Циркулярная РНК ciRS-7 действует как губка для miR-7, которая сама нацелена на мРНК нескольких генов, участвующих в воспалении. Секвестрируя miR-7, ciRS-7 косвенно способствует развитию воспаления при псориазе.41
HOX Transcript Antisense RNA (HOTAIR)
HOTAIR - это lncRNA, которая повышена в псориатической коже. Она способствует воспалению, регулируя провоспалительные цитокины, такие как IL-6 и IL-8. HOTAIR также способствует пролиферации и миграции кератиноцитов.42
LncRNA Maternally Expressed Gene 3 (MEG3)
MEG3 снижается в очагах псориаза и участвует в модуляции пролиферации кератиноцитов, воспаления и иммунного ответа.43
Terminal Differentiation-Induced Noncoding RNA (TINCR)
TINCR участвует в дифференцировке кератиноцитов и формировании эпидермального барьера. Дисрегуляция TINCR может привести к аномальной дифференцировке, что является отличительной чертой псориаза. Эта ncRNAs играет различные роли в регуляции воспалительных реакций, пролиферации, дифференцировки кератиноцитов и формирования эпидермального барьера, что является важнейшими аспектами патогенеза псориаза.
Понимание функций этих ncRNAs позволяет понять молекулярные механизмы, лежащие в основе заболевания, и может предложить потенциальные мишени для разработки новых терапевтических стратегий лечения псориаза (Таблица 1).
44 Для разработки генотерапии псориаза следует подчеркнуть значение миРНК (miRNAs), которые играют важную роль в различных клеточных процессах, включая апоптоз, пролиферацию клеток, морфогенез, дифференциацию клеток, регуляцию метаболизма и передачу сигналов. Хорошо известна их способность регулировать множество генов и тот факт, что один ген может регулироваться разными типами миРНК (рис. 2).
45,46 Исследования миРНК и их потенциальной роли при псориазе в основном сосредоточены на бляшечной форме, при этом в псориатической коже выявлено более 250 миРНК с нарушением экспрессии.
47 Известно, что миРНК играют важнейшую роль в регулировании развития подмножеств воспалительных клеток и контроле интенсивности воспалительного ответа путем модуляции своих генов-мишеней. Эти молекулы могут регулировать несколько ключевых процессов, участвующих в патогенезе псориаза, включая дифференцировку кератиноцитов, их пролиферацию и цитокиновый ответ, а также активацию Т-клеток, их выживание и взаимодействие между иммуноцитами и кератиноцитами путем регулирования выработки хемокинов и цитокинов.
48-50 Многочисленные исследования показали, что определенные миРНК, обнаруженные в сыворотке крови, могут быть потенциальными биомаркерами для оценки тяжести псориаза и мониторинга ответа на лечение. Кроме того, последние исследования показали, что ингибирование миРНК может стать перспективной терапевтической стратегией для лечения псориаза..
Table 1 List of Non-Coding RNAs in the Pathogenesis of Psoriasis
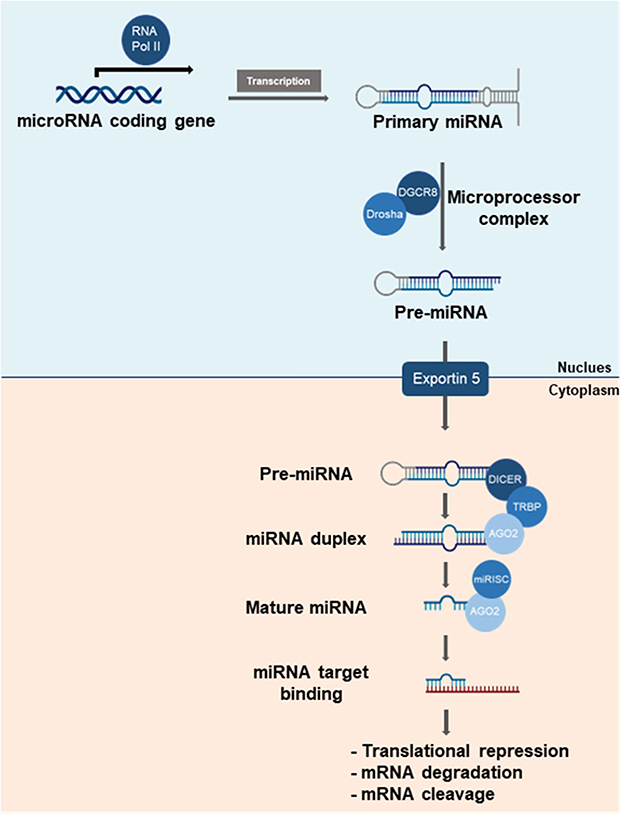
Figure 2
Gene silencing mechanisms of miRNA. The transcription of miRNA genes occurs in the nucleus via RNA polymerase II, yielding a primary miRNA (pri-miRNA) that is then cleaved by Drosha into a precursor miRNA (pre-miRNA). Exportin 5 mediates the transport of pre-miRNA to the cytoplasm where Dicer cleaves it into mature miRNA. The miRNA is then loaded onto the RISC complex, where the passenger strand is eliminated, and the guide strand directs RISC to partially complementary target mRNA. The binding between the guide strand and target mRNA leads to various modes of target inhibition, including translational repression, degradation, or cleavage.
Gene Therapy in Psoriasis
Несмотря на значительный прогресс в медицинских исследованиях, полного излечения от псориаза пока не существует. Поэтому управление заболеванием имеет решающее значение для улучшения качества жизни людей, страдающих этим заболеванием. Хотя это может быть непростой задачей, очень важно держать болезнь под контролем и минимизировать ее последствия. В настоящее время изучаются новые подходы к лечению псориаза, включая стратегии на основе генотерапии, такие как антисмысловые нуклеотиды, РНК-интерференция (RNAi), терапия стволовыми клетками и терапия на основе антител. Учитывая, что псориаз, как считается, в значительной степени зависит от генетики, использование генотерапии в качестве потенциального варианта лечения стало многообещающим подходом.
51 Подавление Т-клеточного иммунного ответа с помощью цитокинов - потенциальная стратегия для уменьшения тяжести псориаза. В клиническом исследовании, проведенном на пациентах с тяжелой формой псориаза, оценивалась эффективность IL-4, цитокина с множеством функций. Результаты исследования показали, что IL-4 может эффективно подавлять псориаз у людей.
52 В одном из исследований Li et al
53 изучалась эффективность трансдермальной доставки плазмиды IL-4 для лечения псориаза в трансгенной мышиной модели с фактором роста эндотелия сосудов (VEGF) K14. В исследовании использовались ультрадеформируемые катионные липосомы для ежедневной доставки 15 мкг плазмидной ДНК, и результаты показали, что этот метод успешно справляется с псориазом. В исследовании, проведенном группой ученых, изучалась новая терапевтическая стратегия лечения псориаза с использованием плазмиды, экспрессирующей IL-4, доставленной с диметилсульфоксидом (ДМСО) в качестве усилителя проникновения.
54 Результаты исследования показали, что этот метод привел к обнаружению уровня IL-4 в коже и значительному улучшению симптомов псориаза на животной модели. Псориаз характеризуется сверхэкспрессией кератина 17 (K17), белка промежуточных филаментов, который специфически присутствует в псориатических поражениях и был вовлечен в патогенез заболевания. Чтобы найти новый подход к лечению псориаза, Chang и соавт.
55 исследовали использование антисмысловых олигодезоксинуклеотидов (ASODNs) и RNAi для снижения экспрессии K17, который, как предполагается, играет роль в развитии заболевания. Была изучена эффективность местного применения антисмысловых олигодезоксинуклеотидов (ASODNs), специфичных для К-17, и инкапсулированной в липосомы малой интерферирующей РНК (siRNA) на мышиных моделях псориаза. Исследование показало, что такая терапия приводит к значительному снижению уровня экспрессии К-17. Было установлено, что такое снижение подавляет пролиферацию кератиноцитов и индуцирует апоптоз.
55 Исследования показали, что не-вирусная соматическая генотерапия, направленная непосредственно на ангиогенез, является перспективным подходом к лечению псориаза, с высокой эффективностью останавливая процесс заболевания.
56 Многочисленные исследования показали, что изменение активности определенных миРНК может оказывать благотворное влияние на здоровье кератиноцитов, потенциально приводя к терапевтическим преимуществам в лечении псориаза
.57 В одном из исследований Xu et al
58 было показано, что miR-125b потенциально может быть терапевтической мишенью для лечения псориаза. Было установлено, что miR-125b является непосредственной мишенью для рецептора фактора роста фибробластов 2 (FGFR2) и ингибирует пролиферацию кератиноцитов, способствуя их дифференцировке в первичных человеческих кератиноцитах. В одном из исследований
59 сообщается, что избыточная экспрессия miR-210 в CD4+ T-клетках приводит к увеличению экспрессии провоспалительных цитокинов, таких как IFN-γ и IL-17, а также к снижению экспрессии регуляторных цитокинов, таких как IL-10 и TGF-β. Согласно исследованиям, проведенным Guinea-Viniegra и др.57 , животные модели псориаза показали многообещающие результаты терапии анти-miR-21. Кроме того, в исследовании
40 было обнаружено, что TGF-β1 повышает экспрессию miR-31, а снижение уровня miR-31 в первичных человеческих кератиноцитах приводит к снижению экспрессии IL-1β и IL-8. Основываясь на результатах предыдущих исследований,
57, 60, стимулирование экспрессии miR-125b и ингибирование miR-31 или miR-210 являются перспективными терапевтическими стратегиями для лечения псориаза, которые могут быть подкреплены экспериментальными данными, дающими ценное представление о глубинных механизмах заболевания. Еще одна потенциальная стратегия лечения псориаза предполагает использование молекул RNAi, которые стали перспективным классом терапевтических средств благодаря своей способности заглушать гены, воздействуя на транскрипты мРНК. Этот подход приобрел интерес в последние годы благодаря возможности разработки молекул RNAi для многих генов (рис. 3).
61 В одном из исследований, проведенных Desmet et al
62 , было обнаружено, что комбинированная терапия на основе siRNA, направленная на гены DEFB4, TSLP и KRT17, привела к снижению экспрессии этих ключевых генов, вовлеченных в псориаз, а также уменьшению маркеров дифференциации и кератинизации, что указывает на потенциальную эффективность в лечении псориаза. Одна из стратегий лечения псориаза предполагает воздействие на множество генов, связанных с заболеванием, на уровне эпидермальных кератиноцитов, что обещает потенциальные терапевтические преимущества.
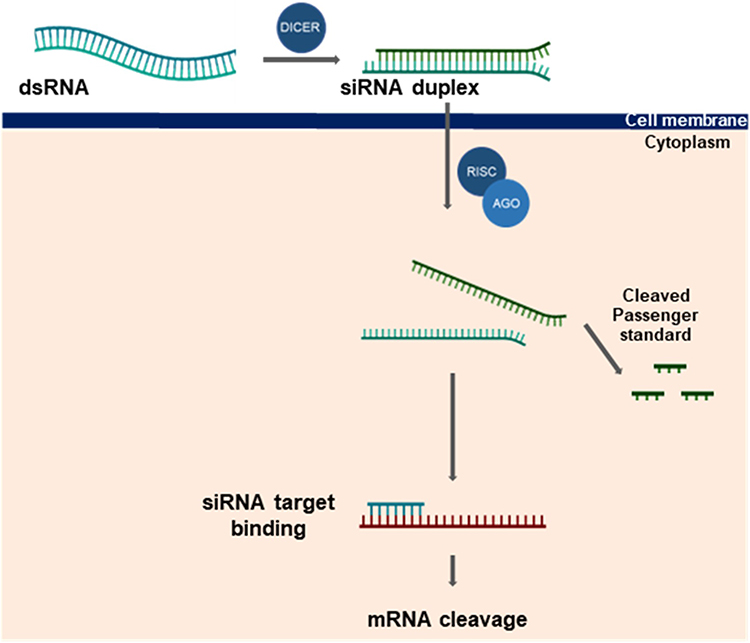
Figure 3
Gene silencing mechanisms of siRNA. Dicer processes dsRNA (either endogenous or exogenous) into siRNA, which is incorporated into the RISC complex. The passenger strand of siRNA is cleaved by AGO2, a component of RISC, leaving the guide strand to direct the complex to the complementary mRNA target. Upon binding, the guide strand initiates cleavage of the target mRNA, leading to gene silencing.
В одном из недавних исследований, проведенных Mandal et al63, изучалось использование ионных жидкостей для доставки NFKBIZ siRNA в кожу для лечения псориаза. Результаты показали, что лечение было эффективным в подавлении экспрессии аберрантных генов и снижении уровня связанных с псориазом сигналов, таких как TNF-α и IL-17A, что свидетельствует о его потенциальной терапевтической эффективности при псориазе. Lee et al49 использовали абляционные лазеры для доставки наноносителей, которые могут быть эффективны для нацеливания IL-6 siRNA на кожу и ослабления псориазиформного дерматита. Существует множество методов лечения псориаза, но ни один из них не дает окончательного излечения. Лечение псориаза значительно изменилось благодаря достижениям в области биопрепаратов и генотерапии с возможной целью длительного контроля над смягчением псориаза.
MicroRNA Therapeutics in the Psoriasis-Like Animal Models
МиРНК - это тип молекул РНК, которые не кодируют белки и обычно состоят примерно из 22 нуклеотидов.64,65 Одним из заметных открытий в исследованиях псориаза является связь между измененной экспрессией миРНК и заболеванием, о которой было сообщено еще в 2007 году. На сегодняшний день, по данным различных исследований, выявлено более 250 миРНК, которые имеют дифференциальную экспрессию в псориатической коже или крови.66 МиРНК способны регулировать различные клеточные процессы в клетках кожи, включая пролиферацию, дифференцировку, апоптоз и выработку цитокинов, а также активацию и функцию подмножеств Т-клеток.40,67-69 Недавние исследования также показали, что некоторые миРНК, присутствующие в крови больных псориазом, могут служить биомаркерами для диагностики, мониторинга и лечения заболевания, поскольку они коррелируют с показателями индекса тяжести псориаза (PASI).70,71 Кроме того, было показано, что генетические вариации миРНК способствуют восприимчивости к псориазу.72 Таким образом, миРНК являются важной мишенью для лечения псориаза.
Многие исследования использовали IMQ для изучения различных механизмов действия миРНК и терапевтического эффекта при псориазе. van der Fits и др. провели исследование с использованием нормальных мышей, не подвергшихся генетической модификации.73 Эти исследователи лечили мышей с помощью IMQ, который является лигандом для TLR7 и TLR8, в течение шести дней подряд. Этот метод позволил им создать временную модель псориазоподобного заболевания. Исследователи использовали модель IMQ для изучения miR-126,74 miR-145-5p,75 miR-146a/b,76,77 miR-148a,78 miR-149,79 miR-155,80 miR-193b-3p, 81 miR-205-5p,82 miR-210,69,83 miR-21-3p/IL-22,84 miR-215-5p,85 miR-31,40 miR-340,86 и miR-let-7b87 у мышей (Таблица 2).
<а href="https://www.tandfonline.com/doi/full/10.2147/DDDT.S447780#"> Table 2 Compilation of Previous Studies Investigating miRNA Therapeutics Discovery in Animal Models of Psoriasis
В одном из исследований40 недавно сообщалось, что miR-31 нацелена на протеинфосфатазу 6 (PP6) и высоко экспрессируется в псориатической коже. Роль PP6 в сохранении баланса кожи широко признана, а широкий спектр функций серин/треониновых фосфатаз еще больше подчеркивает ее важность.88,89 Для получения мышей с loxP-фланкированными аллелями PP6 (известных как Pp6fl/fl) в сочетании с кератином 5-Cre (K5) был использован метод селекции, который позволил селективно удалять Pp6 из кератиноцитов. Полученные мыши K5.Pp6fl/fl в возрасте 16 недель демонстрировали поражения кожи, характеризующиеся чешуйчатыми бляшками на мордах, ушах, верхней части спины и хвостах. Дальнейший анализ показал, что у этих мышей наблюдалось несколько эпидермальных аномалий, таких как акантоз, гиперкератоз, паракератоз, микроабсцессы на поверхности утолщенного эпидермиса и значительная инфильтрация иммунных клеток в дерму. Чтобы изучить терапевтический потенциал ингибирования аргиназы для лечения псориаза, Yan и др.40 вызвали воспаление кожи, сходное с клиническим проявлением псориаза, подвергнув обезьян синемордых и мышей C57BL/6 воздействию IMQ на заднюю поверхность плеч.
Xu et al58 провели исследование, чтобы выяснить, может ли TGF-β1 регулировать экспрессию miR-31 in vivo. Для этого исследователи изучили экспрессию miR-31 в коже мышей, генетически модифицированных для сверхэкспрессии TGF-β1 (так называемых трансгенных мышей K5.TGF-β1)56. У трансгенных мышей наблюдалось специфическое для эпидермиса увеличение экспрессии TGF-β1 и проявлялся псориаз-подобный фенотип кожи.90-92 Результаты показали, что etanercept успешно уменьшал псориаз-подобные симптомы и снижал экспрессию miR-31 в четыре раза по сравнению с мышами, обработанными солевым раствором. В исследовании также использовался анализ гибридизации in situ, который выявил сверхэкспрессию miR-31 в гиперпластическом эпидермисе трансгенных мышей K5.TGF-β1 по сравнению с мышами дикого типа. Более того, лечение etanercept приводило к уменьшению как гиперплазии эпидермиса, так и экспрессии miR-31. Авторы предположили, что повышение экспрессии miR-31 в кератиноцитах, индуцированное TGF-β1, может быть ответственно за инфильтрацию воспалительных клеток, наблюдаемую у мышей K5.TGF-β1, поскольку потенциально способствует секреции хемоаттрактантов. Исследователи считают, что повышенная экспрессия miR-31 может иметь важные последствия, особенно учитывая жизненно важную роль TGF-β1 и IL-1β в дифференцировке клеток Th17, которые ассоциируются с развитием псориаза. Индукция miR-31 под действием TGF-β1 может вызвать выработку IL-1β, что приведет к обострению Th17-опосредованного воспаления, которое является характерной чертой псориаза.93
Yan et al40 сообщили, что miR-31, который стимулируется NF-κB, играет важную роль в чрезмерном росте эпидермиса при псориазе. Для дальнейшего исследования авторы использовали трансгенную модель мыши с кератином 5-Cre для получения мышей miR-31fl/fl/K5-Cre. Примечательно, что трансгенные мыши K5-Cre были первоначально созданы Mao et al. в 2003 году.94 Дальнейшие исследования, проведенные на живых организмах, показали, что у мышей, дефицитных по IL-17A, наблюдалось заметное снижение уровня каталитической субъединицы протеинфосфатазы 6 (ppp6c) в эпидермисе по сравнению с IL-17A-достаточными мышами после недельного лечения IMQ. 95 Эти данные свидетельствуют о том, что активация NF-κB, вызванная воспалительными цитокинами, подавляет экспрессию ppp6c через индукцию miR-31 в кератиноцитах. Более того, исследователи определили ppp6c как критическую мишень miR-31 в этом процессе.
В своем исследовании Guinea-Viniegra et al57 описали разработку модифицированных нуклеиновыми кислотами anti-miR-21 соединений, которые специфически нацелены на miR-21. Эффективность этих соединений оценивалась на мышиных моделях, похожих на псориаз, и на модели ксенотрансплантации мыши с использованием псориатической ткани, полученной от пациентов. Результаты исследования показали, что ингибирование miR-21 может уменьшить псориатическую патологию, что указывает на потенциальную терапевтическую стратегию. В исследование были включены две группы мышей: одна с генетической модификацией (DKO* мыши JunBf/f; c-Junf/f K5-CreERT) и другая группа без модификации (JunBf/f; c-Junf/f). Чтобы вызвать псориаз-подобный фенотип, исследователи воздействовали на обе группы tamoxifen.96 В этом исследовании также была создана модель ксенотрансплантации мышей с тяжелым комбинированным иммунодефицитом (SCID). Пациенты с диагнозом psoriasis vulgaris и баллом PASI более 15 исследовали с помощью биопсии пораженной кожи глубиной 400 мм, которые получали с помощью дерматома. После получения биопсий площадью 1 см2 образцы пересаживались мышам SCID и покрывались ксероформом и лейкопластырем. За трансплантатами наблюдали в течение трех недель, чтобы убедиться в их стабильности перед началом лечения (табл. 2).
SiRNA Therapeutics in the Psoriasis-Like Animal Models
RNAi - это врожденный механизм регуляции генов, который помогает регулировать клеточные гены и защищать их от чужеродных генетических материалов. Этот механизм избирательно снижает экспрессию генов на пост-транскрипционном уровне, вызывая специфический нокдаун последовательности. RNAi использует клеточные пути, которые обрабатывают двухцепочечные молекулы РНК, которые могут происходить как из эндогенных, так и из чужеродных источников ДНК. Эти пути преобразуют молекулы в короткие двухцепочечные молекулы РНК, длина которых обычно составляет 21-23 нуклеотида.97 Комплекс РНК-индуцированного сайленсинга отвечает за интеграцию молекул siRNA, длина которых обычно составляет 21-23 нуклеотида и которые образуются из двухцепочечных молекул РНК, необходимых для регуляции экспрессии генов. Молекулы siRNA могут интегрироваться в комплекс РНК-индуцированного сайленсинга и расщеплять специфические молекулы мРНК-мишени благодаря идеальной комплементарности между одной из двух нитей siRNA и последовательностью мишени.98 Было показано, что как синтетические дуплексы siRNA, так и кодируемые ДНК короткие шпилечные РНК (shRNA) эффективно воздействуют на заранее определенные мРНК-мишени у лабораторных животных, эффективно обрабатываясь клеточным механизмом RNAi.99-103 Использование инструментов RNAi широко распространено в исследованиях на животных и показывает потенциал для терапевтического применения у людей благодаря использованию эффекторов малых РНК.104
Недавно исследователи освоили новую методику воздействия на недавно выявленные гены, представляющие интерес в мышиных моделях псориаза, с помощью местного применения siRNA. Этот подход, который не требует много времени и может быть использован в моделях острого или хронического псориаза, завоевал популярность среди исследователей. Хотя приобретение достаточного количества siRNA может быть дорогостоящим, он остается более экономичной альтернативой созданию новой линии мышей с помощью генной инженерии. Различные исследования оценивали IL-6,
30 c-Rel,
105 IFI27,
106 K17,
107 Pcsk9,
108 PLA2G4B,
109 TNIP1,
110 и Trim21-siRNA
111 в мышиной модели IMQ для изучения влияния потенциальных siRNA-терапевтических средств на псориаз (Таблица 3).
Table 3 Compilation of Previous Studies Investigating siRNA Therapeutics Discovery in Animal Models of Psoriasis
Согласно исследованиям, существующие методы лечения псориаза, такие как специфические антагонисты TNF-α, связываются непосредственно с TNF-α и снижают его уровень. Однако избыточная экспрессия TNF-α в псориатических поражениях кожи в первую очередь связана с активацией MAPK-активируемой протеинкиназы 2 (MK2), которая регулирует пост-транскрипционные механизмы.114,115 В результате, воздействие только на белок TNF-α может оказаться неэффективной стратегией лечения псориаза. Остается неясным, будет ли более эффективным подходом воздействие на мРНК TNF-α вместо белка. Jakobsen et al112 исследовали потенциал использования кодируемых ДНК малых РНК-эффекторов для воздействия на мРНК TNF-α посредством RNAi Эта группа провела эксперимент с использованием лентивирусных векторов, кодирующих shRNA, в модели трансплантации ксенотрансплантата псориаза. Результаты показали снижение фенотипа псориаза, о чем свидетельствовали улучшение клинических показателей, уменьшение толщины эпидермиса и снижение уровня мРНК TNF-a в обработанной коже. Авторы исследования получили биопсию кожи пациентов с псориазом, содержащую эпидермис и дерму, с помощью кератома, и использовали эти образцы для создания модели трансплантации ксенотрансплантата псориаза. Авторы исследования разделили каждый кератомный биоптат кожи на несколько трансплантатов, где каждый трансплантат имел размеры 1,5х1,5х0,05 см. Затем эти трансплантаты пересаживали 6-8-недельным мышам C.B-17 SCID, как описано ранее.94 Исследование показало, что использование малых РНК, нацеленных на 3' UTR гена TNF-α, посредством лентивирусной доставки может инициировать эффективный RNAi ответ в псориатической коже человека. Следовательно, этот метод может стать терапевтической стратегией для лечения псориаза, поскольку он успешно облегчил псориатический фенотип в модели трансплантации ксенотрансплантата.112
В исследовании Bracke et al113 изучалась эффективность применения SECosomes, содержащих DEFB4-siRNA, для воздействия на hBD-2 с помощью биоинженерной модели псориаза на коже гуманизированной мыши. Авторы обнаружили, что лечение SECosomes, содержащими DEFB4-siRNA, привело к значительному улучшению псориатического фенотипа, о чем свидетельствует нормализация архитектуры кожи, уменьшение количества и размера дермальных кровеносных сосудов, а также восстановление активности трансглутаминазы, экспрессии ilaggrin и внешнего вида рогового слоя. Эти результаты свидетельствуют о том, что технология SECosome в сочетании с кожно-гуманизированной мышиной моделью псориаза может стать ценным до-клиническим инструментом для выявления потенциальных терапевтических мишеней при этом заболевании (табл. 3).
Other Gene Therapeutics and Psoriasis-Like Animal Models
Доставка вакцин и терапевтических препаратов путем местного переноса генов в кожу представляет собой многообещающую стратегию благодаря своей неинвазивности и безболезненности. Li et al
53 показали, что местная доставка мышиного IL-4 (mIL-4) была эффективна для лечения псориазоподобных симптомов в модели трансгенной мыши K14-VEGF с использованием IL-4, доставленного через ультрадеформируемые катионные липосомы. Этот результат подчеркивает потенциал топического переноса генов как перспективного направления для лечения различных дерматологических заболеваний у людей. В другом исследовании,
116, трансгенная модель мыши K14-VEGF была использована в качестве инструмента для использования преимуществ модели IMQ и сохранения ее эффективности. В этом исследовании было установлено, что в модели мышей K14-VEGF, индуцированной IMQ, воспаление кожи было значительно более сильным, чем в модели мышей дикого типа, индуцированной IMQ. Авторы исследования проверили стабильность воспаления на 8, 10 и 13 день и отметили, что оно оставалось неизменным на протяжении всего периода наблюдения. Это исследование было направлено на улучшение существующей модели и показало, что мышь K14-VEGF, индуцированная IMQ, может стать ценным инструментом для изучения псориаза (табл. 4).
Table 4 List of Other Applications Discovery in Animal Models of Psoriasis
Jin et al120 использовали модель морской свинки с псориазиформными поражениями кожи, вызванными propranolol. Морские свинки-самки весом 250-400 г были подвергнуты воздействию псориаз-подобного поражения кожи, вызванного пропранололом. Лечение заключалось в местном нанесении 5% пропранолола в эмульгирующей мази на дорсальные поверхности ушных раковин дважды в день в течение трех недель. Известно, что эта модель имеет признаки, сходные с теми, что наблюдаются при псориазе у человека, включая гиперкератоз, паракератоз и акантоз.
В исследованиях, проведенных в прошлом, подробно описано создание мышей K5tTA и TetosTie2, а также получение двойных трансгенных мышей KC-Tie2 путем генотипирования. Псориазиформное воспаление кожи, повышение уровня цитокинов IL-23 и IL-17A, провоспалительный моноцитоз и нейтрофилия наблюдались в модели мышей K5tTA и TetosTie2 с двойным трансгеном KC-Tie2. Примечательно, что эти симптомы предшествовали образованию тромбов в сонной артерии.119 Li et al121 провели исследование, в котором лечили мышей KC-Tie2 антителами, направленными против IL-23, IL-17A или IL-17RA, и сообщили о результатах, сходных с клинической эффективностью, наблюдаемой у пациентов с псориазом. Согласно результатам исследования, введение антител к IL-23, IL-17A или рецептору IL-17A (IL-17RA) мышам KC-Tie2 продемонстрировало клиническую эффективность, аналогичную наблюдаемой у пациентов с псориазом, что привело к задержке образования окклюзионных тромбов и уменьшению акантоза. Примечательно, что при уменьшении воспаления кожи наблюдалось снижение количества нейтрофилов в селезенке, в то время как уровень моноцитов и Т-клеток оставался неизменным. Исследователи показали, что ингибирование функции IL-23 или IL-17A в уже существующей мышиной модели псориаза может уменьшить воспаление кожи, снизить количество циркулирующих нейтрофилов и продлить время свертывания тромбов. Результаты исследования позволяют предположить, что воздействие на цитокины, вызывающие псориатическое воспаление, может облегчить сопутствующие сердечно-сосудистые заболевания.
Помимо изучения моногенных заболеваний кожи, все большее внимание уделяется выяснению молекулярной генетики, лежащей в основе воспалительных заболеваний кожи, таких как экзема и псориаз, с целью поиска новых терапевтических подходов, направленных на борьбу с этими мутациями.122 В настоящее время активно исследуются новые терапевтические стратегии, направленные на борьбу с мутациями, лежащими в основе псориаза. Мутации гена CARD14, вызывающие повышение уровня воспалительных цитокинов, были выявлены при нескольких подтипах псориаза.123 Псориаз связан с различными генетическими факторами, включая инфламмасому NLRP3, которая может вызывать повышенный воспалительный ответ и устойчивость к лечению глюкокортикоидами. На мышиных моделях было продемонстрировано, что совместное введение Cas9, нацеленного на NLRP3, с дексаметазоном может облегчить симптомы псориаза, такие как отек кожи, инфильтрация тучных клеток и общая воспалительная активность, в большей степени, чем лечение Cas9-NLRP3 или дексаметазоном в отдельности.118, 124
Точный патогенетический механизм, посредством которого редкие аутосомные мутации в CARD14 способствуют развитию предрасположенности к псориазу у людей, остается неизвестным, несмотря на установленную ассоциацию. Mellett et a117 недавно провели исследование с использованием мышиной модели с усиленной мутацией Card14ΔE138, полученной от пациентов с псориазом. Результаты исследования показали, что гиперактивация CARD14 сама по себе может инициировать иммунопатогенные пути, ответственные за псориаз, через ось IL-17/IL-23. У трансгенных мышей Card14ΔE138 наблюдаются различные гистопатологические признаки и экспрессия генов, схожие с псориазом у человека. При лечении трансгенных мышей Card14ΔE138, которые демонстрируют псориатический фенотип, сходный с человеческим, нейтрализующим антителом IL-23p19, экспрессия антимикробных пептидов и провоспалительных цитокинов, связанных с псориазом, снижается. Это исследование позволяет предположить, что трансгенная модель мыши Card14ΔE138 является клинически значимой для изучения псориаза (табл. 4).
Expert Opinion
Будущее моделей псориаза представляется многообещающим, и новые генетические методы, позволяющие удалять, истощать или отслеживать меченые клетки in vivo, открывают новые пути для определения молекулярных и клеточных путей, которые связывают воспаление, начавшееся в коже, с повреждением отдаленных органов. По мере создания моделей, основанных на генетических локусах, выявленных с помощью GWAS, ожидается более глубокое понимание специфических генных мутаций и их последствий. Новые мышиные модели могут быть созданы с использованием комбинации передовых методов анализа последовательностей и системной биологии, таких как секвенирование объемной РНК (RNASeq), пространственное RNASeq и одноклеточное RNASeq, а также новых методов, таких как цитометрия по времени полета (CyTOF) и омические подходы. Эти методы обещают выявить новые мишени и облегчить разработку новых моделей. Ожидается, что создаваемые модели животных для хронического псориазиформного воспаления улучшат понимание хронических воспалительных реакций, воспалительных контуров и иммунных регуляторных сетей для изучения ключевых событий, которые запускают сложные иммунологические пути. Ожидается, что исследования, направленные на уточнение хронических воспалительных реакций, воспалительных контуров и иммунной кибернетики в будущих животных моделях хронического псориазиформного воспаления, позволят получить важные сведения о глубинных механизмах хронического воспаления и связанных с ним заболеваний.
В этом обзоре мы кратко излагаем несколько ключевых моментов: 1. Мы обобщили последние исследования в области анти-псориатической генотерапии на различных животных моделях псориаза. 2. Новые методы лечения псориаза охватывают генотерапию, представляя перспективные направления с использованием микроРНК, lncRNA и комплексов РНК-интерференции. 3. Таргетинг ключевых генов псориаза непосредственно с помощью разработанных миРНК в моделях псориатических животных оказывается ценным для разработки терапии псориаза на основе миРНК. 4. Потенциал siRNA в изменении пост-транскрипционных путей и нацеливании на дисрегуляторные гены привлек внимание к лечению псориатических животных моделей.
Conclusion
В настоящее время генотерапия не является жизнеспособным вариантом лечения псориаза, однако все большее внимание уделяется изучению генетических факторов, лежащих в основе этого заболевания. Несмотря на значительные инвестиции в разработку лекарств, процент успеха новых препаратов в клинических испытаниях остается удручающе низким. Моноклональные антитела, применяемые при псориазе средней и тяжелой степени, дают временное облегчение без генетических изменений. Генотерапия и моноклональные антитела представляют собой разные подходы к лечению псориаза. Генотерапия демонстрирует потенциал для устранения первопричин и обеспечения длительного эффекта, хотя она остается экспериментальной и вызывает проблемы с безопасностью и этикой. Выбор зависит от степени тяжести псориаза, предпочтений пациента и доступности лечения. В будущем, по мере развития персонализированной медицины, некоторым пациентам может помочь сочетание обоих подходов.125
Результаты, полученные на животных моделях, играют решающую роль в устранении разрыва между доклиническими исследованиями и клиническими испытаниями. В настоящее время обсуждаются проблемы и ограничения, связанные с использованием животных моделей,9,126 причем особое внимание уделяется их валидации для конкретной цели. Более того, существуют установленные рекомендации, которые помогают в выборе, разработке и применении животных моделей для исследовательских целей. Кроме того, предлагается использовать гуманизированные мышиные модели и до-клиническую оценку клинических особенностей для улучшения клинической трансляции.
Манипулирование генами в одной и той же ткани-мишени может оказывать различное воздействие на разные отделы кожи, что отражает разнообразную патофизиологию псориаза (рис. 4). Например, сравнение транскрипционных профилей пяти мышиных моделей (IMQ, K14-амфирегулин, K5.TGF-b, K5.Tie2 и K5.Stat3C) с псориазом человека показало сходство в эпидермисе, но различия в профилях, связанных с иммунитетом.
127 Для устранения генетических вариаций у людей и животных с однородным генетическим фоном генетически модифицируют с помощью целевых мутаций в отдельных генах. Помимо генетических модификаций, при изучении псориаза необходимо учитывать влияние эпигенетической регуляции и взаимодействие между генетическими локусами восприимчивости. Поэтому генетический фон играет в этом процессе решающую роль. Хотя животные модели псориаза обладают определенными преимуществами, они имеют свои ограничения и не могут полностью повторять человеческие условия. Использование иммунодефицитных животных с приживлением человеческой кожи и иммунных клеток становится все более популярным благодаря потенциальным преимуществам, но оно также имеет определенные ограничения. Хотя приживление человеческой кожи и иммунных клеток иммунодефицитным животным имеет свои преимущества, такие как устранение генетических вариаций у людей, оно имеет и недостатки. По словам James Krueger, исследователя псориаза из Университета Рокфеллера в Нью-Йорке, интеграция клеточной биологии, профилирования экспрессии, генетики и терапии привела к комплексному пониманию этого заболевания. Профессор Крюгер считает, что такой трансляционный подход, когда все части головоломки органично сочетаются друг с другом, можно применить и к другим аутоиммунным заболеваниям и раку.
128

Figure 4
A summary of various methods used to create animal models for studying psoriasis. Various techniques have been utilized to generate animal models of psoriasis, with each method resulting in chronic inflammatory hyperproliferative skin phenotypes that bear resemblance to psoriasis. These manipulations, which involve different cell types and molecular mechanisms, may induce the development of hyperproliferative inflammatory skin changes, suggesting diverse pathogenic mechanisms (elaborated in the text).
 Figure 1 A simplified diagram illustrating the structural alterations in human skin affected by psoriasis. Normal skin structure (left) and compared with psoriatic skin (right). The formation of scaly, raised, red plaques on the skin, accompanied by I. acanthosis; II. parakeratosis; III. hyperkeratosis; IV. Munro’s microabscess. These plaques can be uncomfortable and itchy, causing pain and irritation.
Figure 1 A simplified diagram illustrating the structural alterations in human skin affected by psoriasis. Normal skin structure (left) and compared with psoriatic skin (right). The formation of scaly, raised, red plaques on the skin, accompanied by I. acanthosis; II. parakeratosis; III. hyperkeratosis; IV. Munro’s microabscess. These plaques can be uncomfortable and itchy, causing pain and irritation.
 Figure 2 Gene silencing mechanisms of miRNA. The transcription of miRNA genes occurs in the nucleus via RNA polymerase II, yielding a primary miRNA (pri-miRNA) that is then cleaved by Drosha into a precursor miRNA (pre-miRNA). Exportin 5 mediates the transport of pre-miRNA to the cytoplasm where Dicer cleaves it into mature miRNA. The miRNA is then loaded onto the RISC complex, where the passenger strand is eliminated, and the guide strand directs RISC to partially complementary target mRNA. The binding between the guide strand and target mRNA leads to various modes of target inhibition, including translational repression, degradation, or cleavage.
Figure 2 Gene silencing mechanisms of miRNA. The transcription of miRNA genes occurs in the nucleus via RNA polymerase II, yielding a primary miRNA (pri-miRNA) that is then cleaved by Drosha into a precursor miRNA (pre-miRNA). Exportin 5 mediates the transport of pre-miRNA to the cytoplasm where Dicer cleaves it into mature miRNA. The miRNA is then loaded onto the RISC complex, where the passenger strand is eliminated, and the guide strand directs RISC to partially complementary target mRNA. The binding between the guide strand and target mRNA leads to various modes of target inhibition, including translational repression, degradation, or cleavage.
 Figure 3 Gene silencing mechanisms of siRNA. Dicer processes dsRNA (either endogenous or exogenous) into siRNA, which is incorporated into the RISC complex. The passenger strand of siRNA is cleaved by AGO2, a component of RISC, leaving the guide strand to direct the complex to the complementary mRNA target. Upon binding, the guide strand initiates cleavage of the target mRNA, leading to gene silencing.
Figure 3 Gene silencing mechanisms of siRNA. Dicer processes dsRNA (either endogenous or exogenous) into siRNA, which is incorporated into the RISC complex. The passenger strand of siRNA is cleaved by AGO2, a component of RISC, leaving the guide strand to direct the complex to the complementary mRNA target. Upon binding, the guide strand initiates cleavage of the target mRNA, leading to gene silencing.
 Figure 4 A summary of various methods used to create animal models for studying psoriasis. Various techniques have been utilized to generate animal models of psoriasis, with each method resulting in chronic inflammatory hyperproliferative skin phenotypes that bear resemblance to psoriasis. These manipulations, which involve different cell types and molecular mechanisms, may induce the development of hyperproliferative inflammatory skin changes, suggesting diverse pathogenic mechanisms (elaborated in the text).
Figure 4 A summary of various methods used to create animal models for studying psoriasis. Various techniques have been utilized to generate animal models of psoriasis, with each method resulting in chronic inflammatory hyperproliferative skin phenotypes that bear resemblance to psoriasis. These manipulations, which involve different cell types and molecular mechanisms, may induce the development of hyperproliferative inflammatory skin changes, suggesting diverse pathogenic mechanisms (elaborated in the text).