)
Семейство синдеканов, гепаран сульфат протеогликанов клеточной поверхности, обнаруживает специфический паттерн экспрессии в головном мозге крыс. Синдекан-1 сначала ограничен гранулярными клетками мозжечка, тогда как синдекан-4 спецефически экспресируется глиальными клетками, астроцитами.
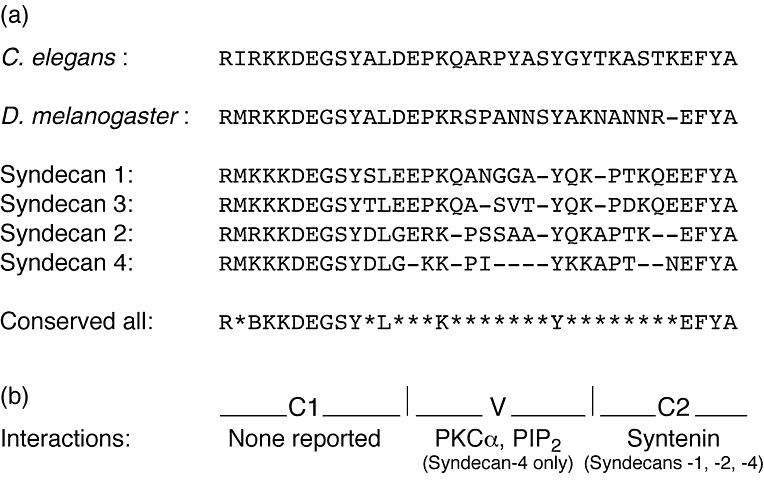
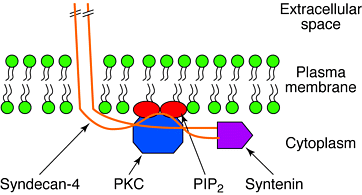
В переднем мозге экспрессируются в основном синдекан-2 и синдекан-3, последний концентрируется в аксонах, тогда как синдекан-2 локализуется в синапсах, но на поздних стадиях синаптического развития. Внеклеточные области всех синдеканов обнаруживают ограниченное сходство последовательностей за исключением сайта GAG цепи. Слабая консервация указвает на то, что скорее гепарансульфатная сторона цепи, чем сердцевина белка отвечает за внеклеточные взаимодействия синдеканов. Однако отмечается высокоая консервация последовательносте в коротком цитоплазматическом С-конце синдеканов. Последовательность EFYA связывается с PDZ доменами синтенина и CASK. Существенные различия между синдеканами обнаруживаются в середине цитоплазматического хвоста, она, по-видимому, ассоциирует с разынми внутриклеточными белками, участвующими в таргетинге и/или передаче сигналов.
Синдекан-связывающий белок CASK/LIN-2 является цитоплазматическим связывающим партнером для синдеканов. Его распределение меняется от первоначального распределения в аксонах ( 2 первые недели постнатального развития) до распределения в телах и дендритах нейронов во взрослом головном мозге. Это измененние коррелирует с паттерном экспрессии синдекана-3 и -2. Следовательно, оба синдекана ассоциируют с CASK в различных компартментах нейронов в ходе постнатального развития. Предполагается, что синдекан-3- CASK комплекс может участвовать как в адгезивных, так и сигнальынх функциях во время роста, миграции и фасцикуляции аксонов .
Синдеканы рассматриваются как гепаран сульфат протеогликаны клеточной поверхности, участвующие в адгезии между клетками и матриксом, или как ко-рецепторы с низким сродством для гепарин-связанного роста и/или факторов дифференцировки. После расщепления ( отщепления цитоплазматическог эпитопа) синдекановые эктодомены могут сбрасываться с клеточных оболочек и ассоцировать с внеклеточным матриксом и служить хранилищем внеклеточных гепарн сульфат протеогликанов, действовать как "хапероны".
Синдеканы в сердце
мРНК syndecan-3 и glypican обильно экспрессируются в сердце взрослых. Обнаружены также низкий уровень мРНК syndecan-2 и очень низкий уровень syndecan-1 мРНК. Анализ РНК, выделенной из сердца крыс разных стадий развития показал, что уровень мРНК syndecan-3 и glypican увеличивает резко при рождении и продолжает поддерживаться на высоком уровне у взрослых. Глипикановая мРНК локализовалась почти исключительно в кардиомиоцитах. мРНК синдекана-3 не обнаруживалась в миоцитах. Эти результаты демонстрируют онтогенетическую и клеточно-специфическую экспрессию membrane heparan sulfate proteoglycans в сердце (Asundi et al., 1997).
Протеогликаны клеточной поверхности участвуют в адгезии клеток, в передаче сигналов факторов роста, активности липазы и антикоагуляции. Роль каждого индивидуального вида протеогликана на путях передачи клеточных сигналов известна. Большая трансмембранная группа heparan sulfate proteoglycans, syndecans, играют важную роль как добавочные сигнальные молекулы, модулирующие базирующуюся на интегринах адгезию.
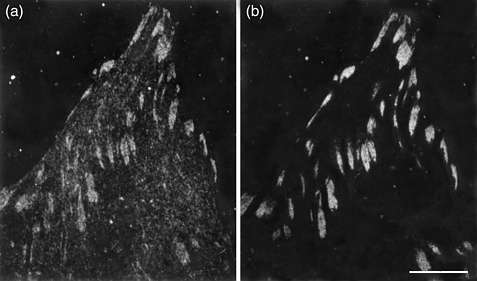
Большинство составляющих клеточного поведения испытывает влияние или контролируется за счет взаимодейстивий с ВКМ. Интегрины, наиболее изученное семейство рецепторов для макромолекул матрикса. Известно, чтосемейство синдеканов, трансмембрнных протеогликано, м. действовать как ко-рецепторы, модулируя интегринами обусловленную межклеточную адгезию. Синдеканы м. контролировать клеточный фенотип и организацию актинового цитоскелета, а определенные события передачи сигналов появляются после связывания синдеканов с помощью heparin-связывающих сайтов в матричных молекулах. Связывание интегринов с матричными лигандами ведет к активации сложных нижестоящих сигнальных путей. Известно, что синдеканы функционируют как ко-рецепторы для сигнальных событий, инициируемых семейством fibroblast growth factor (FGF) и участвуют в др. биологических процессах. Вместе с интегринами они формируют двойную рецепторную систему, активную в соединениях клеток с матриксом и, по-видимому, в межклеточных соединениях.