NPAT
NPAT
; Роль в развитии и эволюции; The expanding roles of Nr6a1 in development and evolution" /> Ползователи: 
ЯДЕРНЫЙ РЕЦЕПТОР Nr6a1
Роль в развитии и эволюции
The expanding roles of Nr6a1 in development and evolution АВТОРЫ et al.
 Front. Cell Dev. Biol., 19 February 2024
|
The Nuclear Receptor (NR) family of transcriptional regulators possess the ability to sense signalling molecules and directly couple that to a transcriptional response. While this large class of proteins are united by sequence and structural homology, individual NR functional output varies greatly depending on their expression, ligand selectivity and DNA binding sequence specificity. Many NRs have remained somewhat enigmatic, with the absence of a defined ligand categorising them as orphan nuclear receptors. One example is Nuclear Receptor subfamily 6 group A member 1 (Nr6a1), an orphan nuclear receptor that has no close evolutionary homologs and thus is alone in subfamily 6. Nonetheless, Nr6a1 has emerged as an important player in the regulation of key pluripotency and developmental genes, as functionally critical for mid-gestational developmental progression and as a possible molecular target for driving evolutionary change in animal body plan. Here, we review the current knowledge on this enigmatic nuclear receptor and how it impacts development and evolution.

|
Nuclear receptors: an overview
Суперсемейство регуляторов транскрипции ядерных рецепторов, как известно, представляет собой внутриклеточные рецепторы, конформационное изменение которых в ответ на связывание лиганда приводит к прямому воздействию на транскрипцию (общий обзор см. в Frigo et al., 2021). NR встречаются во всем животном мире: от 2 NR, обнаруженных у губки Amphimedon queenslandica (Bridgham et al., 2010), 48/49 NR, обнаруженных у человека/мыши, соответственно, и до 73/74 у teleosts, таких как рыбки данио и тилапия (Zhao et al., 2015). Филогенетический анализ разделил суперсемейство NR на 7 структурно различных групп (NR0-NR6; Bridgham et al., 2010; Holzer et al., 2017), которые можно разделить на три ветви: связанные со стероидными гормонами, связанные с гормонами щитовидной железы и связанные с рецепторами ретиноидов X. Такая сложная диверсификация NR по линиям животных позволила понять их возможные предковые функции и поставить вопрос о том, были ли предковые NR регулируемыми лигандами (обзор в Holzer et al., 2017).
Некоторые хорошо охарактеризованные лиганды NR включают гормон щитовидной железы, стероидные гормоны, такие как эстроген, прогестерон и глюкокортикоиды, а также производные витамина А и витамина D. По большей части эти небольшие липофильные молекулы свободно диффундируют через клеточные мембраны, за исключением тиреоидного гормона, который требует рецептор-опосредованного транспорта. После интернализации эти хорошо охарактеризованные примеры действуют как высокоаффинные лиганды для своего рецептора. Однако также очевидно, что многие NR связывают различные метаболиты и липиды с низкой аффинностью, что увеличивает сложность взаимодействия NR с лигандами.
С таким разнообразным и примечательным списком лигандов неудивительно, что активность NR имеет решающее значение на протяжении всей жизни животных, включая ранний эмбриональный рост и формирование паттерна, переходные процессы в развитии и метаморфоз, размножение, метаболизм и гомеостаз взрослого организма (McKenna et al., 1999; Escriva et al., 2000; Robinson-Rechavi et al., 2003). Более того, нарушение регуляции сигнализации NR при многих патологических состояниях человека, включая диабет, многочисленные виды рака, сердечно-сосудистые заболевания, астму и неврологические синдромы (Ranhotra, 2013; Oyekan, 2011; Lonard and O'Malley, 2012; Kadmiel and Cidlowski, 2013; Mazaira et al., 2018), вызвала повышенный интерес к терапевтическому воздействию на функцию NR. Действительно, по разным оценкам, 15-20 % доступных в настоящее время терапевтических препаратов модулируют функцию NR. Однако только около половины человеческих NR имеют известные лиганды, а те, у которых лиганды не охарактеризованы, называются сиротскими NR. В данном обзоре речь пойдет о сиротском ядерном рецепторе Nuclear receptor subfamily 6 group A member 1 (Nr6a1), идентифицированном в 1994 году и первоначально называвшемся Germ cell nuclear factor (GCNF), Retinoid receptor-related testis-associated receptor (RTR) или Neuronal cell nuclear factor в соответствии с различными контекстами, в которых был идентифицирован один и тот же фактор (Chen et al., 1994; Hirose et al., 1995; Bauer et al., 1997).
Nr6a1: structural insight
Консенсусная структура NR состоит из i) низко-консервативного по длине и последовательности N-концевого домена (NTD), который обычно содержит область активаторной функции-1 (AF-1), взаимодействующую с белками-корегуляторами транскрипции, ii) высококонсервативный домен связывания ДНК (DBD), iii) дискретный лиганд-связывающий домен (LBD), который не только взаимодействует с лигандом (лигандами), но и привлекает белки-корегуляторы транскрипции, и iv) шарнирная область, соединяющая DBD и LBD (рис. 1) (Escriva et al. , 2000; Khorasanizadeh and Rastinejad, 2001; Bain et al., 2007; Gallastegui et al., 2015). Nr6a1 занимает только группу подсемейства 6 и, несмотря на то, что ранее его называли рецептором яичек, связанным с ретиноидными рецепторами, более тесно связан с белками ветви стероидных гормонов (Papageorgiou et al., 2021). По сравнению с другими NR, в LBD-области Nr6a1 отсутствует домен активаторной функции-2 (AF-2), хотя соответствующая область может способствовать рекрутированию ко-репрессоров и димеризации (Greschik et al., 1999; Zechel, 2005). Коллективные исследования, основанные в основном на классических анализах сдвига подвижности в геле, показали, что ДНК-связывающая область Nr6a1 с большим сродством связывается в гомодимере, чем в мономере, с прямым повтором с нулевым интервалом (DR0) консенсусной последовательности AGGTCA или расширенным полусайтом TCAGGTCA (Chen et al., 1994; Borgmeyer, 1997; Yan et al., 1997; Cooney et al., 1998; Schmitz et al., 1999). По крайней мере in vitro, Nr6a1 не димеризуется с ретиноидным Х-рецептором (Borgmeyer, 1997). Gu et al. (2005) предположили, что эндогенный Nr6a1 образует еще более крупный олигомерный комплекс под названием transiently retinoid-induced factor (TRIF), для сборки которого требуется ДНК. Конечно, последовательность полусайта была подтверждена как обогащенная в Nr6a1-связанных регионах с помощью иммунопреципитации хроматина Flag-HA-меченного белка Nr6a1, экспрессированного в мезенхимных стволовых клетках (Gurtan et al., 2013), и точная природа того, какой белковый комплекс более высокого порядка Nr6a1 образует in vivo, еще требует выяснения.
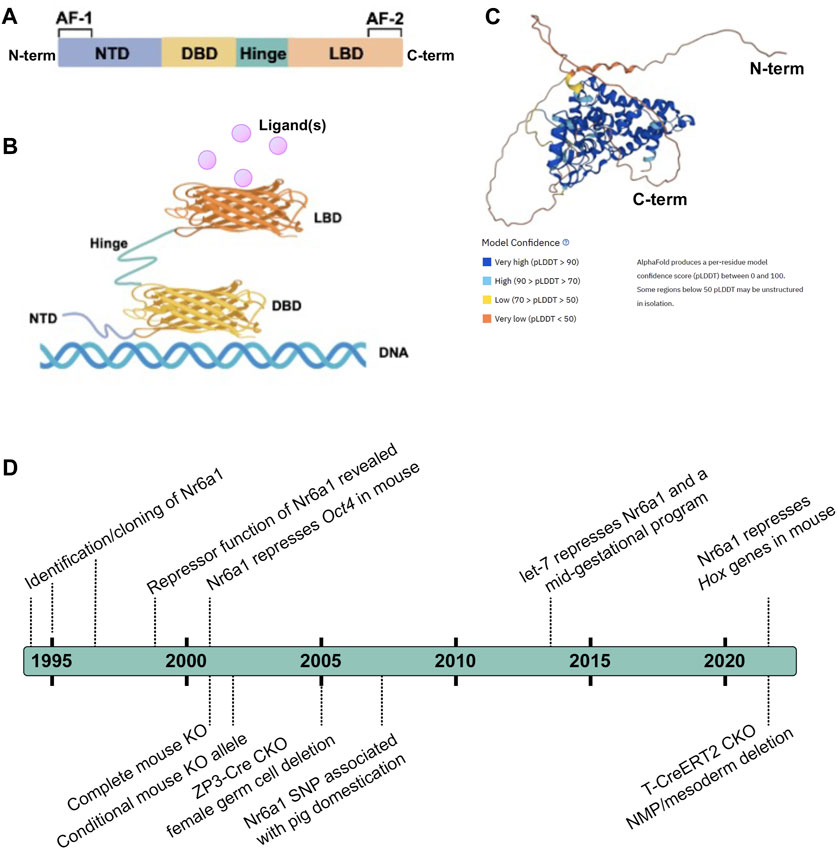 . FIGURE 1. Nr6a1 Structural insight (A,B) Schematised structure of a canonical Nuclear Receptor. Nuclear receptors have a less conserved N-terminal domain (NTD) which harbours an activator function-1 (AF-1) region, a highly conserved DNA binding domain (DBD), a ligand-binding domain (LBD) that harbours an activator function-2 (AF2), and a hinge domain linking the DBD and LBD. (C) Predicted 3-Dimensional structure of human Nr6a1, generated by AlphaFold (Jumper et al., 2021; Varadi et al., 2022), model confidence indicated. (D) A timeline of key milestones in the identification and functional assessment of Nr6a1.
Dynamic Nr6a1 expression
Первоначальная характеристика экспрессии Nr6a1 в тканях взрослых мышей и человека выявила экспоненциально более высокие уровни Nr6a1 в семенниках по сравнению с другими органами, при этом низкий уровень экспрессии был отмечен в тканях яичников, почек и легких (Chen et al., 1994). Клеточный анализ с помощью гибридизации in-situ показал, что Nr6a1 локализуется в зародышевых клетках мужского семенника и женского яичника (Chen et al., 1994). В мужских половых клетках высокая экспрессия была отмечена на заключительной стадии развития круглых сперматид с резким снижением во время удлинения сперматидных клеток, что позволяет предположить, что Nr6a1 может действовать как постмейотический фактор, ограничивающий развитие (Katz et al., 1997; Cooney et al., 1999; Yang et al., 2003). Однако в развивающихся ооцитах экспрессия Nr6a1 была обнаружена до завершения мейоза, но не в примордиальных фолликулах, что свидетельствует о более ранней роли Nr6a1 в этом контексте во время инициации оогенеза (Katz et al., 1997).
Во время эмбрионального развития мыши Nr6a1 был обнаружен в эктодерме уже на 6,5 день эмбрионального развития, и его экспрессия продолжалась на всех стадиях гаструляции как в переднем и заднем нейроэпителии, так и в зарождающейся мезодерме, выходящей из задней части примитивной полоски (Fuhrmann et al., 2001). В возрасте E8.5 экспрессия оказалась специфичной для нейрональной эктодермы и задней зоны роста (Chung et al., 2001), по крайней мере, на уровне гибридизации in situ всего эмбриона, при отсутствии экспрессии в развивающемся сердце. Исследование набора данных секвенирования одиночных клеток мыши E8.5 (Pijuan-Sala et al., 2019) подтвердило широкое распространение экспрессии в типах клеток всех трех зародышевых слоев, с высокой частотой в каудолатеральной части эпибласта и в популяции бипотенциальных нейромезодермальных (NMP) предшественников (Chang et al., 2022), оба ключевых источника предшественников для развивающегося спинного мозга и позвоночного столба (Henrique et al., 2015). К ст. E9.5 экспрессия остается сильной в передних двух третях эмбриона, включая развивающиеся черепно-лицевые структуры, конечности, нервную трубку и сомиты туловища, но заметно очищается в задней пресомитной мезодерме и области хвостовой почки (Chung et al., 2001; Chang et al., 2022). В E10.5 наблюдается общее снижение уровня Nr6a1, экспрессия которого ограничена клетками, по-видимому, ганглиев дорсальных корешков ствола и мигрирующего черепного нервного гребня, хотя требуется дальнейшая характеристика. К ст. E12.5 большая часть экспрессии Nr6a1 исчезает, что свидетельствует о жестко контролируемом и ограниченном по времени режиме регуляции транскриптов.
Следует отметить, что как в первоначальном, так и в более позднем исследовании экспрессии in situ использовался рибозонд, обнаруживающий 3'-UTR-область транскрипта Nr6a1. При огромном количестве секвенирования транскриптов, доступных в настоящее время, становится ясно, что геномный локус Nr6a1 продуцирует множество изоформ транскрипта, которые могут влиять на потенциал кодирования белка (рис. 2А). На смысловой нити имеется по крайней мере 2 основных альтернативных транскрипта с потенциалом кодирования и множество дополнительных транскриптов (не показаны), потенциал кодирования которых не определен и которые, вероятно, являются не кодирующими РНК ( ncRNAs). Кроме того, на антисмысловой нити образуются два частично перекрывающихся длинных транскрипта ncRNAs ( lnc-Nr6a1-1 и lnc-Nr6a1-2) и транскрипт, кодирующий микроРНК ( mir-181-a2 и mir-181-b2). Недавний анализ in vitro показал, что индуцированный Tgf-β эпителиально-мезенхимальный переход быстро повышает уровень всех антисмысловых транскриптов, при этом lnc-Nr6a1-1 и обе пре-миРНК изначально транскрибируются как более крупная единица (Polo-Generelo et al., 2022). В настоящее время неясно, контролируется ли и каким образом функциональность белка Nr6a1 на уровне экспрессии альтернативных транскриптов, а также существует ли согласованная регуляция смысловых и антисмысловых транскриптов in vivo- положительная или обратная корреляция, как это часто наблюдается для пар смысловой-антисмысловой.
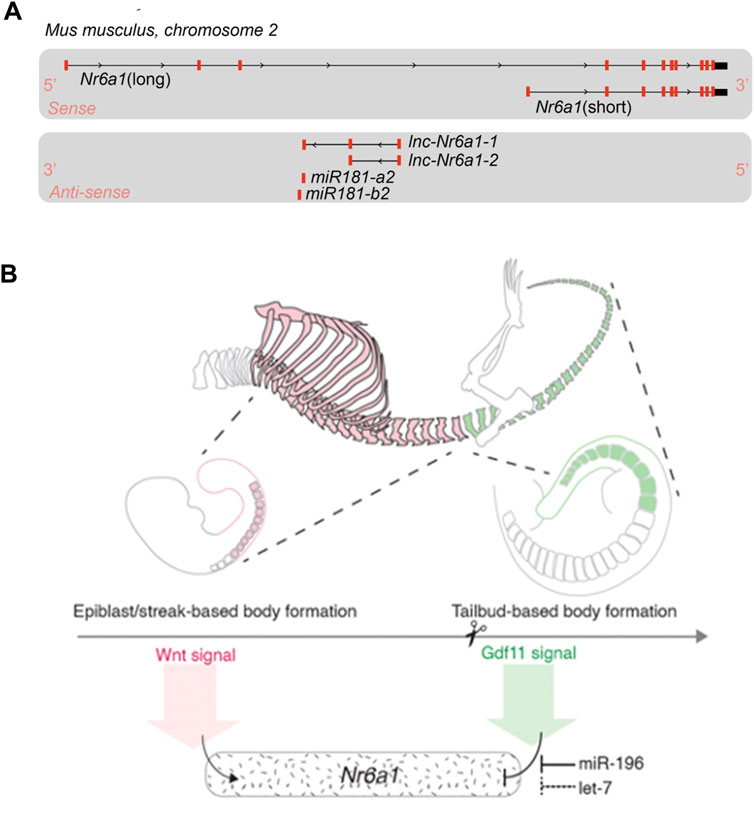 FIGURE 2. Nr6a1 genomic structure and transcript regulation (A) The Nr6a1 genomic locus of Mus musculus. Exons marked in red, not to scale. Multiple Nr6a1 transcripts with coding potential have been identified on the sense strand, while both long non-coding antisense and micro-RNA encoding transcripts are produced from the opposite strand. (B) Nr6a1 expression is defined by key developmental signals/regulators known to control axial elongation. Nr6a1 expression increases in response to Wnt signalling, while the synergistic actions of Gdf11 and miR-196, and potentially let-7 expression, terminate Nr6a1 expression at the trunk-to-tail transition.
Regulatory mechanisms controlling Nr6a1 expression
Своевременная индукция и прекращение экспрессии Nr6a1 в процессе развития и дифференцировки очень важны. Первые сведения о регуляторных факторах, способных индуцировать экспрессию Nr6a1, появились после идентификации этого гена в качестве гена-мишени раннего ответа в клетках эмбриональной карциномы, которые под действием ретиноевой кислоты (RA) превращались в нейральные клетки (Bauer et al., 1997; Heinzer et al., 1998). Впоследствии этот вывод был подтвержден на эмбриональных стволовых клетках мыши (Sato et al., 2006) и человека (Wang et al., 2016), обработанных RA, а также in vivo после экзогенного применения RA к эмбриону Xenopus (Barreto et al., 2003). Интересно, что между Nr6a1 и ключевым ферментом биосинтеза RA Aldh1a2 существует определенная отрицательная обратная связь: полная потеря Nr6a1 in vivo приводит к пространственно дискретному повышению уровня Aldh1a2 в хвостовом бутоне (Chung et al., 2001), и наоборот, Aldh1a2 является одним из наиболее низко экспрессирующихся транскриптов в хвостовом зачатке после избыточной экспрессии Nr6a1 in vivo (Chang et al., 2022). Были выявлены дополнительные индукторы высокого уровня экспрессии Nr6a1 in vitro, включая фактор роста фибробластов и сигнальные пути Wnt (Chang et al., 2022). Во время дифференцировки ESC в бипотенциальный предшественник NMP добавление FGF2 (индуцирующего переход ESC в эпибласт) приводило к увеличению Nr6a1 примерно в 80 раз, а последующее добавление агониста пути Wnt CHIR99021 (индуцирующего переход эпибласта в NMP) - к дальнейшему увеличению в 175 раз по сравнению с ESC. В естественных условиях пространственно-временной контекст относительного вклада в индукцию еще предстоит выяснить, однако зависимость от Wnt/Fgf хорошо коррелирует с сильной экспрессией Nr6a1 в естественных условиях на заднем плане между ст. E7.5-E8.5.
Чуть позже в процессе развития гибридизация in situ и анализ РНК-секвенирования одиночных клеток продемонстрировали резкое удаление Nr6a1 из задней зоны роста дикого типа на ключевом этапе развития, известном как переход от ствола к хвосту (примерно ст. E9.5 у мыши). Этот переход знаменует окончание первичного удлинения тела и регулируется во времени с помощью сигнализации Gdf11 (McPherron et al., 1999; Jurberg et al., 2013), так и семейством микроРНК miR-196 (Wong et al., 2015), вероятно, у всех видов позвоночных (He et al., 2011; Matsubara et al., 2017). Наша группа показала, что добавление Gdf11 к клеткам NMP, полученным in vitro, почти полностью отменяет экспрессию Nr6a1, возвращая ее к низким уровням, наблюдаемым в ESC (Chang et al., 2022). In vivo было показано, что Gdf11 и miR-196 играют индивидуальную и аддитивную роль в своевременном удалении Nr6a1 в этом месте, причем клиренс Nr6a1 функционально опосредует, по крайней мере частично, роль Gdf11 в этой критической точке перехода. Интересно, что семейство микроРНК Let-7, как предсказано, также широко нацелено на 3'-UTR Nr6a1 мыши и человека (McGeary et al., 2019) и, таким образом, можно предположить, что оно также участвует в своевременном клиренсе Nr6a1. Было экспериментально подтверждено, что Let-7 подавляет Nr6a1 в рамках широкой "среднегестационной" генетической сигнатуры в мезенхимных стволовых клетках мыши (Gurtan et al., 2013), а генетическое уменьшение паралогов Let-7 у мыши увеличивает число хвостовых позвонков на 5 элементов (Robinton et al., 2019). Является ли этот последний фенотип частично обусловлен репрессией Nr6a1, неизвестно, хотя, возможно, и маловероятно, учитывая, что трансгенная избыточная экспрессия Nr6a1 в заднем хвостовом бутоне показала, что присутствие Nr6a1 пагубно влияет на морфологию хвостовых позвонков (Chang et al., 2022). Однако возможно, что let-7 действует совместно с Gdf11 и miR-196 в чуть более ростральных местах, и для его изучения потребуется сложная генетика мыши. В целом, экспрессия Nr6a1 жестко контролируется во время формирования эмбриона ключевыми сигналами развития и пост-транскрипционными регуляторными механизмами, некоторые из которых рассматриваются как регуляторы сроков развития, что побуждает к детальному функциональному исследованию в этом контексте.
Nr6a1 is essential for embryonic survival
Полная генетическая делеция Nr6a1 у мыши выявила его незаменимую роль в развитии в середине беременности и в выживании эмбрионов (Chung et al., 2001). На самых ранних стадиях эмбриогенеза Nr6a1-/- не проявляли явных нарушений, однако к ст. E8.5 эмбрионы Nr6a1-/- начинали демонстрировать явные морфологические дефекты, включая открытую нервную трубку и дезорганизацию примитивной полоски и задних тканей, которые усугублялись с течением времени. Аллантоис был больше, чем у WT, с дефектами прикрепления хориона, а ткани задней части эмбриона стали аномально расширяться и располагаться за пределами желточного мешка. К ст. E9.5 эмбрионы Nr6a1-/- не поворачивали заднюю половину главной оси тела, как это обычно наблюдается на этой стадии у эмбрионов WT, и демонстрировали дополнительные задние изменения в развитии задней кишки и вентральной стенки тела. Сомитогенез был сильно нарушен, и общий рост эмбрионов был замедлен, хотя на этой стадии все еще наблюдалось некоторое региональное расширение передних и задних тканей. Самая поздняя временная точка, в которой были восстановлены жизнеспособные эмбрионы Nr6a1-/-, была E10.5, хотя и в соотношении ниже менделевских ожиданий, и только резорбирующиеся эмбрионы Nr6a1-/- наблюдались на сьт. E11.5. Причина летальности точно не установлена, но, вероятно, она связана с изменением хориоаллантоисного прикрепления и/или перетяжкой перикарда. Этиология последнего дефекта не сразу очевидна, поскольку экспрессия Nr6a1, по-видимому, в значительной степени отсутствует в сердце на ст. E8.5-9.5, но остается возможным, функционирует ли Nr6a1 в очень ранних мезодермальных полях сердца. Важная молекулярная мишень Nr6a1, фактор плюрипотентности Oct4/Pou5f1, как выяснилось, эктопически экспрессируется в большей части соматической ткани у нулевых эмбрионов E8.5 Nr6a1 (Fuhrmann et al., 2001), когда этот ген обычно сильно ограничен зародышевой линией. Эти комплексные исследования и последующая повсеместная делеция Nr6a1 DBD с помощью технологии Cre/LoxP, фенокопирующая ранние результаты Nr6a1 null (Lan et al., 2002), дали широкие мазки для понимания требований Nr6a1 во время раннего развития. Однако катастрофические дефекты, возникающие в результате глобальной делеции Nr6a1, ограничивают возможность охарактеризовать более поздние эмбриональные или взрослые требования или тканеспецифические функции этого важного регулятора.
Nr6a1 is essential for embryonic survival
Используя оригинальный нулевой аллель Nr6a1, было показано, что начальная сегрегация линии половых клеток (примордиальных половых клеток; PCGs) во время раннего эмбриогенеза и ранняя миграция PCGs не требуют функции Nr6a1 (Sabour et al., 2014). Поскольку эмбрионы с нулевым Nr6a1 погибают вскоре после этих стадий, был проведен ex vivo нокдаун Nr6a1 (Nra61-KD) в стволовых клетках семенников, полученных из зародышевой линии, и трансдуцированные клетки были повторно введены в семенные канальцы, обедненные зародышевыми клетками. Как контрольные, так и Nr6a1-KD-клетки смогли заново заселить эту среду, но к 3 месяцам Nr6a1-KD-клетки так и не произвели функциональных сперматозоидов по сравнению с контрольными (Sabour et al., 2014). Для изучения роли Nr6a1 в созревающих ооцитах взрослой самки мыши была использована модель условного нокаута Zp3-Cre (Lan et al., 2003). Фенотипически гомозиготная условная делеция не влияла на количество половых клеток, но приводила к снижению фертильности из-за удлиненного диэструса эстрального цикла, аномального стероидогенеза и двойных ооцитных фолликулов. Молекулярная этиология этих преимущественно неклеточных автономных последствий связана с потерей репрессии Bmp-15 и Gdf-9, двух членов семейства секретируемых лигандов TGF-b, которые, как известно, имеют решающее значение для женской репродукции (Carabatsos et al., 1998; Erickson and Shimasaki, 2001; Zhao et al., 2007). Это привело к снижению уровня фолликулостимулирующего гормона (FSH) и стероидных гормонов, продуцируемых соматическими клетками, именно в период диэструса, что и обусловило наблюдаемые фенотипические последствия. В отличие от этого, отдельный условный подход, удаляющий LBD Nr6a1 со ст. E10.5 с помощью вездесущей и временно контролируемой линии Cre deleter, показал удивительное отсутствие эффекта на инициацию мейоза или ранний оогенез (Okumura et al., 2013). Последующий химерный подход in vivo с использованием Nr6a1-нулевых ESC, введенных в эмбрион WT на стадии бластоцисты, выявил сниженный вклад в развитие зародышевой линии при отсутствии активности Nr6a1 (Sabour et al., 2014). Затем эти химерные гонады были имплантированы под капсулу почки для дальнейшего развития, и через 4 недели после трансплантации в химерных гонадах с Nr6a1-нулевыми ESC присутствовали только дегенерированные ооциты по сравнению с нормальным развитием ооцитов, наблюдаемым в контрольных WT-химерных гонадах.
Nr6a1 has a regionally-critical role in elongation of the main body axis
Позвоночный столб и спинной мозг возникают из предшественников задней зоны роста, при этом ткани последовательно строятся в течение нескольких дней в направлении спереди назад (A-P; head-to-tail). Резкое прекращение экспрессии Nr6a1 в задней зоне роста дикого типа на ст. E9.5 (Chung et al., 2001), подтвержденное одноклеточным РНК-секвенированием NMP in vivo (Gouti et al., 2017), позволило предположить, что функция Nr6a1 может быть регионально ограничена во время осевого удлинения позвоночных. Для проверки этого предположения была использована условная делеция Nr6a1 с помощью тамоксифен-индуцибельной линии Cre deleter, активной в осевых предшественниках и ранней мезодерме (TCreERT2), что позволило обойти раннюю эмбриональную летальность, наблюдаемую у нулевых эмбрионов Nr6a1 и проанализировать скелетные изменения у эмбрионов поздних стадий. По сравнению с осевой формулой WT, состоящей из 7 шейных (C), 13 грудных (T), 6 поясничных (L), 4 крестцовых (S) и 30-31 хвостового позвонка, условный нокаут (CKO) активности Nr6a1 со ст. E7.5 приводил к дозозависимому уменьшению числа элементов стволовых позвонков с увеличением дисморфологии позвонков и сращений ребер (Chang et al., 2022). КО одного аллеля Nr6a1 уменьшил число грудных элементов на 2, а КО обоих аллелей Nr6a1 привел к уменьшению числа грудных элементов на 4. В каждом из этих мутантных сценариев общее число позвонков уменьшилось на 1 и 3 элемента соответственно,это подтверждает необходимость Nr6a1 в поддержании осевой элонгации. Параллельно с этим, хотя вся поясничная область эмбрионов TCreERT2; Nr6a1flx/flx не была изменена с точки зрения количества сегментов, идентичность позвонков почти полностью трансформировалась в идентичность крестцовых элементов на основе характерной морфологии латеральных отростков и слияния. Последний фенотип особенно интересен, поскольку развивающиеся задние конечности, которые обычно выравниваются и в конечном итоге сочленяются с крестцовыми элементами, у эмбрионов TCreERT2; Nr6a1flx/flx были расположены нормально, это подтверждает разобщенность событий формирования паттерна между мезодермой задних конечностей, формирующей боковые пластинки, и мезодермой позвонков, формирующей параксиальный столб. Наконец, в то время как большинство элементов торако-пояснично-крестцового отдела у эмбрионов TCreERT2; Nr6a1flx/flx были сильно дисморфичны, все элементы после крестцового отдела позвонков вернулись к морфологии WT. Этот фенотип можно проследить до стадии сегментации (E10.5), где сразу после последнего крестцового сомита можно было наблюдать поразительный переход к нормальной морфологии сомитов (Chang et al., 2022).
В отличие от описанного выше сценария условной потери функции, усиление функции Nr6a1 в задней зоне роста мыши с помощью транзиторного трансгенного подхода привело к почти зеркальным фенотипическим изменениям (Chang et al., 2022). Они включали в себя увеличение числа фенотипически нормальных торако-поясничных позвонков на 5 элементов и резкий переход на этот раз к крайне дисморфным постсакральным элементам и усечению хвоста. В совокупности эти результаты не только определили критическое участие для Nr6a1 в осевом удлинении, но и выявили совершенно уникальные фенотипы, которые послужат стимулом для дальнейших исследований требований к формированию паттерна, специфичных для конкретной линии, и сетей регуляции генов с осевыми ограничениями, которые влияют на кажущийся единообразным процесс сегментации.
Molecular mechanisms and targets of Nr6a1
Nr6a1 был охарактеризован как репрессор экспрессии генов (Cooney et al., 1998; Yan and Jetten, 2000), и все имеющиеся на сегодняшний день данные подтверждают, что это его единственная регуляторная функция. Ранние работы выявили множество примеров Nr6a1-зависимой репрессии в половых клетках, которые зависели от наличия сайта DR0, включая протамин 1 и 2, mGDPH и ELP в мужских половых клетках (Yan et al., 1997; Hummelke et al., 1998; Yang et al., 2003) и BMP-15 и Gdf-9 в женских половых клетках (Carabatsos et al., 1998; Erickson and Shimasaki, 2001; Zhao et al., 2007).
Безусловно, одной из наиболее заметных сетей генов-мишеней, на которые непосредственно влияет активность Nr6a1, является сеть плюрипотентности. Высокие уровни экспрессии Pou5f1/Oct4 являются частью основной сети, поддерживающей плюрипотентность в бластоцисте мыши in vivo и в ESC, полученных из бластоцисты in vitro. Было показано, что по мере дифференцировки в обеих системах снижение и окончательное прекращение экспрессии Oct4 обратным образом коррелирует с повышением уровня экспрессии Nr6a1 (рис. 3A,B) (Fuhrmann et al., 2001; Gu et al., 2005), что согласуется с известным репрессивным режимом действия Nr6a1. Последовательность DR0 была идентифицирована непосредственно перед стартовым сайтом транскрипции Oct4 мыши (Fuhrmann et al., 2001), а затем и многих видов позвоночных (Wang et al., 2016), причем прямое связывание с этим сайтом было подтверждено в эмбриональных клетках мыши, ESC мыши и ESC человека. В этих различных контекстах было показано, что белок Nr6a1 напрямую взаимодействует с белками-корепрессорами SMRT и N-Cor в эмбриональных клетках мыши (Fuhrmann et al., 2001), метилтрансферазой DNMT3b в ESC человека (Sato et al, 2006), а также Dnmt3A и метил-CpG связывающим доменом (MBD) белков MBD-2 и MBD-3 в ESC мыши (Gu et al., 2011), что подтверждает деацетилирование гистонов и метилирование ДНК de novo как основные механизмы, с помощью которых Nr6a1 снижает экспрессию генов-мишеней Oct4. Как и Oct4, второй ключевой ген плюрипотентности Nanog напрямую репрессируется Nr6a1, оказывая косвенное репрессивное воздействие на более крупную сеть, включающую Sox2, Stella и Fgf4 (Gu et al., 2005).
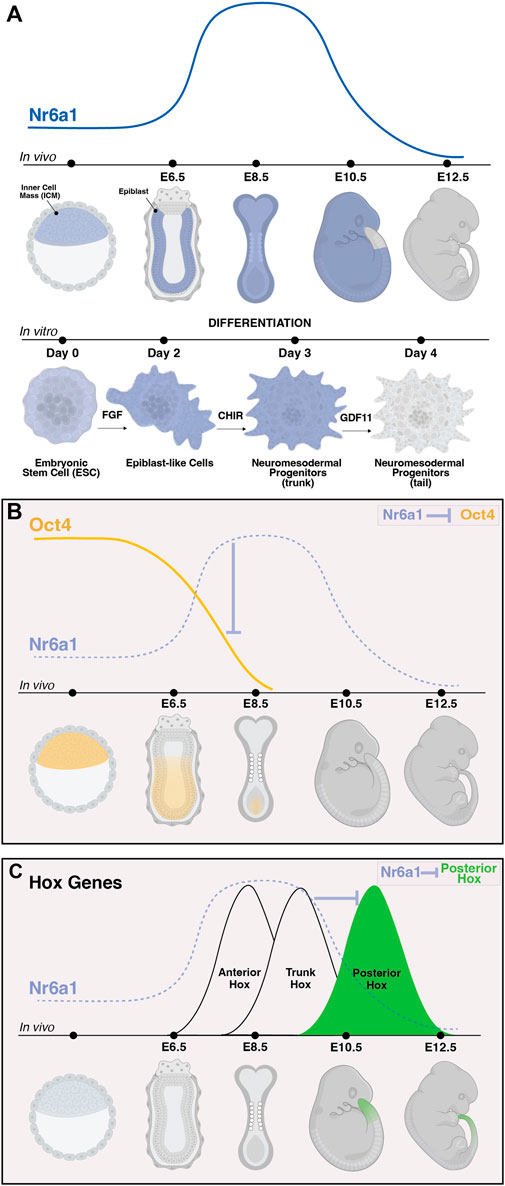 FIGURE 3. The dynamic expression of Nr6a1 controls key developmental genes and transitions. The expression of Nr6a1 over time in vivo and during in vitro differentiation (A). In vivo, Nr6a1 expression is detected within the inner cell mass (ICM) at very early stage of mouse development, broadly within the epiblast (epi) at embryonic day (E)6.5, across most tissues and germ layers at E8.5, with a gradual clearing of expression beginning with the posterior tail bud from E9.5 and expression largely cleared from the embryo by E12.5. A similar expression dynamic is seen during in vitro ESC-to-NMP differentiation: Nr6a1 expression within ESCs increases following exposure to Fgf2, and further increases following activation of Wnt signalling (CHIR). The transition in vitro from a trunk NMP to a tail NMP following exposure to Gdf11 downregulates Nr6a1 to low/basal levels. The dynamic in vivo expression of Nr6a1 overlaid with key target genes Oct4 and posterior Hox genes (B,C). The rise of Nr6a1 within the epiblast directly repress Oct4 levels, leading to broadly complementary patterns of expression between early and mid-gestation (B). Conversely, the rise of Nr6a1 prevents precocious expression of posterior Hox genes, leading to broadly complementary patterns of expression between mid and late-gestation (C). Whether posterior Hox repression by Nr6a1 is via direct mechanisms is currently unclear. Images created in Biorender.
На более поздних стадиях развития хвостового бутона у мыши глобальные изменения экспрессии, вызванные in vivo эктопической активностью Nr6a1, выявили поддержание основной сети регуляции генов ствола (Chang et al., 2022) дольше, чем у дикого типа, что соответствует Nr6a1-зависимой "программе середины беременности", выявленной в мезенхимных стволовых клетках (Gurtan et al., 2013). Особенно важно, что активность Nr6a1 существенно влияет на время активации генов всех 4 кластеров Hox, центральных регуляторов формирования плана тела у билатерий (обзор в Hubert and Wellik, 2023). Эктопическая экспрессия Nr6a1 затормозила прогрессию активации генов Hox в стволе (Hox5-9) с сопутствующей даунрегуляцией (или, вероятно, отсроченной активацией) задних/терминальных (Hox11-13) генов. И наоборот, потеря активности Nr6a1, как in vitro, так и in vivo, приводила к ускорению прогрессии Hox-кластера и преждевременной активации задних/терминальных Hox-генов (рис. 3C) (Chang et al., 2022). Параллельно было показано, что Nr6a1 влияет на баланс нейральных и мезодермальных генных сигнатур в хвостовом бутоне. Необходима дальнейшая работа, чтобы понять прямую и непрямую регуляторную природу каждого из этих взаимодействий, а также то, вовлечены ли изменения в гистоновые метки и метилирование ДНК.
Nr6a1 and the evolution of animal body plan
План тела и вытекающие из него осевые формулы данного вида позвоночных удивительно надежны, особенно для изогенных штаммов мышей, таких как C57Bl6, которые используются во многих генетических исследованиях. В отличие от этого, разнообразие планов тела у разных видов позвоночных может быть чрезвычайно велико, а молекулярные механизмы, вызывающие такие изменения, представляют большой интерес, но до сих пор в значительной степени неизвестны. Поскольку было показано, что точный уровень экспрессии Nr6a1 контролирует общее число позвонков у мыши, как положительно, так и отрицательно, эта работа поднимает возможность того, что Nr6a1 может быть молекулярной мишенью для эволюционных изменений. В поддержку этой точки зрения многочисленные исследования выявили генетическую ассоциацию между Nr6a1 и увеличением числа позвонков у домашних животных - признак, который, возможно, отбирается в животноводстве из-за его преимущества в повышении выхода мяса. В 2005 году Mikawa et al. (2005) провели анализ локусов количественных признаков (QTL), сравнивая популяции домашних свиней и диких кабанов, и выявили области на хромосомах 1 и 7 Sus scrofa, ассоциированные с увеличением числа пресакральных позвонков более чем на два. Последующее точное картирование локусов хромосомы 1 выявило однонуклеотидный полиморфизм (SNP) C>T на нуклеотиде 748 гена Nr6a1, который сегрегационно связан с фенотипом (Mikawa et al., 2007). Этот SNP привел к не-консервативной аминокислотной замене пролина на лейцин в аминокислоте 192 в шарнирной области белка, что при дрожжевом двугибридном анализе привело к усилению связывания между Nr6a1 и корепрессорами NCOR1 и RAP80. Предсказанное молекулярное усиление функции хорошо согласуется с фенотипическими результатами исследований in vivo по усилению функции Nr6a1 в увеличении числа торако-поясничных мышц (Chang et al., 2022). Последующие исследования Zhang et al. (2019) обнаружили A>C SNP в экзоне 8 Nr6a1, который потенциально влияет на количество поясничных позвонков у овец. Аналогичным образом, Fang et al. (2019) выявили делецию 13 п.н. в интроне 1 NR6A1 у различных пород ослов, связав ее с такими признаками размера тела, как рост и длина. Точные молекулярные последствия этих поздних полиморфизмов еще предстоит выяснить, но они подтверждают возможность того, что тонкие изменения в регуляции и/или функции Nr6a1 могли стать важным событием в эволюции внутривидовой изменчивости. В этом свете дальнейший анализ последовательности и функции Nr6a1 у позвоночных животных с экстремальным строением тела, таких как змея, представлял бы большой интерес.
Conclusion
Nr6a1 - критический регулятор развития с новыми функциями при заболеваниях. Его связь с ключевыми сигнальными путями (RA, Wnt и Fgf) и способность репрессировать фундаментальные молекулы развития (Oct4, Nanog, задние Hox-гены) были охарактеризованы в разных контекстах, и необходимо более четкое понимание сходства и различий в функционировании Nr6a1 во времени и пространстве. Однако, учитывая список генов-мишеней, которые репрессирует этот белок, и количественное влияние уровня Nr6a1 на эти мишени (как положительное, так и отрицательное), можно предположить, что Nr6a1 может быть использован для управления позиционными качественными особенностями и/или идентичностью клеток в 3D-моделях развития in vitro либо в своей родной форме, либо в виде модифицированного транскрипционного фактора. Например, манипулируя точным уровнем Nr6a1, можно "ускорить" или "замедлить" Hox-часы в 3D-моделях осевого удлинения, таких как гаструлоиды (Beccari et al., 2018) или сомитоиды (Sanaki-Matsumiya et al., 2022; Yamanaka et al., 2023). Аналогичным образом, нынешняя неспособность многих клеточных или органоидных платформ переходить в зрелое состояние, часто требуемые длительные (следовательно, дорогостоящие) протоколы и истощение пулов предшественников могут быть улучшены путем прямого манипулирования позиционной идентичностью с помощью Nr6a1. В качестве альтернативы, экспрессия Nr6a1 может обеспечить надежный выход из плюрипотентности в бластоидных моделях (Rivron et al., 2018; Liu et al., 2021; Yu et al., 2021) раннего эмбриогенеза.
В будущих исследованиях динамический транскрипционный выход геномных локусов, включающих Nr6a1, антисмысловые транскрипты Nr6a1 и две микроРНК miR-181, требует тщательного изучения in vivo, во-первых, для понимания любой ко-регуляции или анти-регуляции, которая может определять пространственно-временной функциональный выход Nr6a1, и, во-вторых, для определения, имеют ли антисмысловые транскрипты независимые функциональные роли, как было показано in vitro (Polo-Generelo et al., 2022). Как после экспрессии контролируется субклеточная локализация белка Nr6a1 и какие лиганды (если таковые имеются) запускают транскрипционный ответ ниже по течению? Каков полный набор прямых геномных мишеней Nr6a1 in vivo, в частности, в таких недавних областях, как осевое удлинение, и как достигается регуляция генов-мишеней, ограниченная линией развития? Какие белковые комплексы более высокого порядка Nr6a1 направляет в хроматин in vivo и является ли это ограничением по линиям или клеткам? И, наконец, как множество SNPs Nr6a1, выявленных у позвоночных, изменили его молекулярную функцию, и были ли эти изменения важным фактором фенотипических изменений в ходе эволюции.
|
 . FIGURE 1. Nr6a1 Structural insight (A,B) Schematised structure of a canonical Nuclear Receptor. Nuclear receptors have a less conserved N-terminal domain (NTD) which harbours an activator function-1 (AF-1) region, a highly conserved DNA binding domain (DBD), a ligand-binding domain (LBD) that harbours an activator function-2 (AF2), and a hinge domain linking the DBD and LBD. (C) Predicted 3-Dimensional structure of human Nr6a1, generated by AlphaFold (Jumper et al., 2021; Varadi et al., 2022), model confidence indicated. (D) A timeline of key milestones in the identification and functional assessment of Nr6a1.
. FIGURE 1. Nr6a1 Structural insight (A,B) Schematised structure of a canonical Nuclear Receptor. Nuclear receptors have a less conserved N-terminal domain (NTD) which harbours an activator function-1 (AF-1) region, a highly conserved DNA binding domain (DBD), a ligand-binding domain (LBD) that harbours an activator function-2 (AF2), and a hinge domain linking the DBD and LBD. (C) Predicted 3-Dimensional structure of human Nr6a1, generated by AlphaFold (Jumper et al., 2021; Varadi et al., 2022), model confidence indicated. (D) A timeline of key milestones in the identification and functional assessment of Nr6a1.
 FIGURE 2. Nr6a1 genomic structure and transcript regulation (A) The Nr6a1 genomic locus of Mus musculus. Exons marked in red, not to scale. Multiple Nr6a1 transcripts with coding potential have been identified on the sense strand, while both long non-coding antisense and micro-RNA encoding transcripts are produced from the opposite strand. (B) Nr6a1 expression is defined by key developmental signals/regulators known to control axial elongation. Nr6a1 expression increases in response to Wnt signalling, while the synergistic actions of Gdf11 and miR-196, and potentially let-7 expression, terminate Nr6a1 expression at the trunk-to-tail transition.
FIGURE 2. Nr6a1 genomic structure and transcript regulation (A) The Nr6a1 genomic locus of Mus musculus. Exons marked in red, not to scale. Multiple Nr6a1 transcripts with coding potential have been identified on the sense strand, while both long non-coding antisense and micro-RNA encoding transcripts are produced from the opposite strand. (B) Nr6a1 expression is defined by key developmental signals/regulators known to control axial elongation. Nr6a1 expression increases in response to Wnt signalling, while the synergistic actions of Gdf11 and miR-196, and potentially let-7 expression, terminate Nr6a1 expression at the trunk-to-tail transition.
 FIGURE 3. The dynamic expression of Nr6a1 controls key developmental genes and transitions. The expression of Nr6a1 over time in vivo and during in vitro differentiation (A). In vivo, Nr6a1 expression is detected within the inner cell mass (ICM) at very early stage of mouse development, broadly within the epiblast (epi) at embryonic day (E)6.5, across most tissues and germ layers at E8.5, with a gradual clearing of expression beginning with the posterior tail bud from E9.5 and expression largely cleared from the embryo by E12.5. A similar expression dynamic is seen during in vitro ESC-to-NMP differentiation: Nr6a1 expression within ESCs increases following exposure to Fgf2, and further increases following activation of Wnt signalling (CHIR). The transition in vitro from a trunk NMP to a tail NMP following exposure to Gdf11 downregulates Nr6a1 to low/basal levels. The dynamic in vivo expression of Nr6a1 overlaid with key target genes Oct4 and posterior Hox genes (B,C). The rise of Nr6a1 within the epiblast directly repress Oct4 levels, leading to broadly complementary patterns of expression between early and mid-gestation (B). Conversely, the rise of Nr6a1 prevents precocious expression of posterior Hox genes, leading to broadly complementary patterns of expression between mid and late-gestation (C). Whether posterior Hox repression by Nr6a1 is via direct mechanisms is currently unclear. Images created in Biorender.
FIGURE 3. The dynamic expression of Nr6a1 controls key developmental genes and transitions. The expression of Nr6a1 over time in vivo and during in vitro differentiation (A). In vivo, Nr6a1 expression is detected within the inner cell mass (ICM) at very early stage of mouse development, broadly within the epiblast (epi) at embryonic day (E)6.5, across most tissues and germ layers at E8.5, with a gradual clearing of expression beginning with the posterior tail bud from E9.5 and expression largely cleared from the embryo by E12.5. A similar expression dynamic is seen during in vitro ESC-to-NMP differentiation: Nr6a1 expression within ESCs increases following exposure to Fgf2, and further increases following activation of Wnt signalling (CHIR). The transition in vitro from a trunk NMP to a tail NMP following exposure to Gdf11 downregulates Nr6a1 to low/basal levels. The dynamic in vivo expression of Nr6a1 overlaid with key target genes Oct4 and posterior Hox genes (B,C). The rise of Nr6a1 within the epiblast directly repress Oct4 levels, leading to broadly complementary patterns of expression between early and mid-gestation (B). Conversely, the rise of Nr6a1 prevents precocious expression of posterior Hox genes, leading to broadly complementary patterns of expression between mid and late-gestation (C). Whether posterior Hox repression by Nr6a1 is via direct mechanisms is currently unclear. Images created in Biorender.