AV—animal–vegetal;
AVE—anterior visceral endoderm;
CNS—central nervous system;
DV—dorsal–ventral;
Em.Ab—embryonic–abembryonic;
ES—embryonic stem;
ICM—inner cell mass.
Эпителиальные ткани образуют избирательные барьеры проницаемости для различных молекул и клеток для поддержания гомеостаза внутри развивающегося и взрослого организма. Функция эпителиальных клеток зависит во многом от поляризованности индивидуальных клеток в эпителии. Обычно клетки однослойного эпителия поляризованы вдоль апикально-базальной оси. Плазменные мембраны эпителиальных клеток разделены на два функционально отличющихся домена: апикальный и базолатеральный. Базолатеральный домен общается с соседними клетками и внеклеточным матриксом посредством мембранных белков таких как адгезивные молекулы и другие поверхностные клеточные рецепторы. Адгезивные молекулы часто организованы в большие специализированные многобелковые комплексы, называемые клеточными соединениями. Апикальные мембранный домен формирует специализированную поверхность.
У позвоночных межклеточные соединения представлены плотными соединениями, zonula adherens(ZA) и десмосомами.
О полярности энтероцитов смотреть ЗДЕСЬ
О полярности энтероцитов смотреть ЗДЕСЬ
Development of cortical polarity in mouse eggs: involvement of the meiotic apparatus.
Dev Biol 1985, 107: 382–394.
Polarization of mitochondria in unfertilized mouse oocyte.
Dev Genet 1995, 16: 36–43.
Mosaicism in the organization of concanavalin A receptors on the surface membrane of mouse eggs.
Nature 1975, 257: 321–322.
Mechanism of polar body formation in the mouse oocyte: an interaction between the chromosomes, the cytoskeleton, and the plasma membrane.
J Embryol Exp Morphol 1986, 92: 11–37.
Regulation of development in the fully grown mouse oocyte: chromosome-mediated temporal and spatial differentiation of the cytoplasm and plasma membrane.
J Embryol Exp Morphol 1986, 93: 213–238.
A preferential site for sperm-egg fusion in mammals.
Mol Reprod Dev 1991, 28: 183–188.
Ultrastructure of mammalian oocytes and ova.
Biol Reprod Suppl 1970, 2: 44–63.
Is the human oocyte plasma membrane polarized?
Human Reprod 1992, 7: 999–1003.
Preliminary observations on polar body extrusion and pronuclear formation in human oocytes using time-lapse video cinematography.
Hum Reprod 1997, 12: 532–541.
Oocyte influences on early development: the regulatory proteins leptin and STAT 3 are polarized in mouse and human oocytes and differentially distributed within the cells of the preimplantation stage embryo.
Mol Hum Reprod 1997, 3: 1067–1086.
Fertile offspring derived from mammalian eggs lacking either animal or vegetal poles.
Development 1998, 125: 4803–4808.
Role of ooplasmic segregation in mammalian development.
Roux's Arch Dev Biol 1994, 203: 199–204.
Scrambled or bisected mouse eggs and the basis of patterning in mammals.
Bioessays 1999, 21: 271–274.
Sequence and regulation of morphological and molecular events during the first cycle of mouse embryogenesis.
J Embryol Exp Morphol 1985, 87: 175–206.
A reexamination of cleavage patterns in eutherian mammalian eggs: rotation of blastomere pairs during second cleavage in the rabbit.
J Exp Zool 1975, 193: 235–248.
Induction of polarity in mouse 8-cell blastomeres: specificity, geometry and stability.
J Cell Biol 1981, 91: 303–308.
Analysis of polarity of bovine and rabbit embryos by scanning electron microscopy.
Biol Reprod 1994, 50: 163–170.
Polarization of blastomeres in the cleaving rabbit embryo.
J Exp Zool 1990, 256: 84–91.
The foundation of two distinct cell lineages within the mouse morula.
Cell 1981, 24: 71–80.
A quantitative analysis of cell allocation to the trophectoderm and inner cell mass in the mouse blastocyst.
Dev Biol 1987, 119: 520–531.
The establishment of the embryonic–abembryonic axis in the blastocyst.
Development 1987, 100: 125–134.
FgF is an essential regulator of the fifth cell division in preimplantation mouse embryos.
Dev Biol 1998, 198: 105–115.
Promotion of trophoblast stem cell proliferation by FGF 4.
Science 1998, 282: 2072–2075.
Formation of pluripotent stem cells in the mammalian embryo depends on the POU transcription factor Oct 4.
Cell 1998, 95: 379–391.
Regional changes in the binding of [3H] concanavalin A to mouse blastocysts at implantation: an autoradiographic study.
J Exp Zool 1981, 218: 247–251.
Trophectoderm cell subpopulations in the periimplantation mouse blastocysts.
J Exp Zool 1984, 231: 267–271.
Changes in the distribution of vinculin during preimplantation mouse development.
Differentiation 1986, 32: 125–134.
Implanting mouse embryo stain with LNF-1 bearing fluorescent probe at their mural trophectoderm side.
Biochem Biophys Res Commun 1991, 181: 1004–1009.
Expression of fibronectin and fibronectin-binding molecule during preimplantation development in the mouse.
Hum Reprod 1994, 9: 894–901.
The preimplantation mouse embryo is a target for cannabinoid ligand-receptor signalling.
Proc Natl Acad Sci USA 1995, 92: 9460–9464.
Mouse blastocysts hatch in vitro using a trypsin-like proteinase associated with cells of the mural trophectoderm.
Dev Biol 1986, 114: 42–52.
Sites of zona shedding by mouse embryo other than mural trophectoderm.
J Exp Zool 1989, 249: 347–349.
Embryonic axis orientation in the mouse and its correlation with blastocysts relationship to uterus: Part I. Relationships between 82 hours and 4 1/2 days.
J Embryol Exp Morph 1980, 55: 257–277.
The early blastocyst is bilaterally symmetrical and its axis of symmetry is aligned with the animal-vegetal axis of the zygote in the mouse.
Development 1997, 124: 289–301.
Embryonic axis orientation in the mouse and its correlation with blastocysts relationship to uterus: Part II. Relationships from 4 1/2 to 9 1/2 days.
J Embryol Exp Morph 1985, 89: 15–35.
Is the anterior–posterior axis of the fetus specified before implantation in the mouse?
J Exp Zool 1992, 264: 437–443.
Anterior patterning in the mouse.
Trends Genet 1998, 14: 277–284.
Signs of the principle body axis prior to primitive streak formation in the rabbit embryo.
Anat Embryol 1995, 192: 159–165.
Anterior primitive endoderm may be responsible for patterning the anterior neural plate in the mouse embryo.
Curr Biol 1996, 6: 1487–1496.
Complete dissipation of coherent clonal growth occurs before gastrulation in mouse epiblast.
Development 1998, 125: 2397–2402.
An in situ marker for clonal analysis of development of the extraembryonic endoderm in the mouse.
J Embryol Exp Morph 1984, 80: 251–288.
Hex: a homeobox gene revealing peri-implantation asymmetry in the mouse embryo and an early transient marker of endothelial cell precursors.
Development 1998, 125: 85–94.
Smad 2 signaling in extraembryonic tissues determines anterior-posterior polarity of the early mouse embryo.
Cell 1998, 92: 797–808.
Smad 2 role in mesoderm formation, left-right patterning and craniofacial development.
Nature 1998, 393: 786–790.
Cripto is required for correct orientation of the anterior-posterior axis in the mouse embryo.
Nature 1998, 395: 702–707.
Head induction in the chick by primitive endoderm of mammalian, but not of avian origin.
Development 1999, 126: 815–825.
The rotated hypoblast of the chicken embryo does not initiate an ectopic axis in the epiblast.
Proc Natl Acad Sci USA 1995, 92: 10733–10737.
A novel retrovirally-induced embryonic lethal mutation in the mouse: assessment of the developmental fate of ES cells homozygous for the 413.d proviral integration.
Development 1991, 111: 969–981.
Sequential roles for Otx 2 in visceral endoderm and neurectoderm for forebrain and midbrain induction and specification.
Development 1998, 125: 645–856.
| Current Opinion in Genetics & Development Vol. 9, No. 4, August 1999 Polarity in early mammalian development Richard L Gardner Current Opinion in Genetics & Development 1999, 9:417-421. |
Outline
- Oocyte and zygote
- CleAVage
- Blastocyst to early gastrula stage
- Conclusions
- Acknowledgements
- References and recommended reading
Наиболее наглядным проявлением полярности в ооцитах и зиготах млекопитающих является эксцентрическое расположение первого и второго меотических веретен, которое предопределяет лимит потери цитоплазмы в полярные тельца во время друх последовательных раундов сегрегации хромосом. Возникает вопрос, может ли эта асимметрия яца играть роль в формировании паттерна зародыша или эмбриона.
Oocyte and zygote
Oocyte and zygote
Ооцит является поляризованным еще до того как начнется его финальное созревание, на это указывает эксцентричность зародышевого пузырька. После возобновления мейоза полярность становится более выраженной благодаря кортикальному расположению первого и второго вертен мейотических метафаз
[1] и положению первого полярного тельца. В зрелых метафазных II ооцитах мыши полярность отражается в распределении митохондрий, которые не связаны с веретеном. Эти органеллы расположены радиально симметрично вокруг оси ооцита примерно на 2/3 его длины от анимального полюса и почти полностью отсуствуют в остальном вегетативном полушарии[2]. Такое регулярное расположение этих и других органелл не сохраняется в зиготе. После проникновения спермия, когда выталкивается второе полярное тельце, микроворсинки обнаруживают примерно реципрокное распределение по отношению распределения митохондрий в ооцитах мыши, они отсутствуют в области, окружающей веретено метафазы II, которая занимает примерно 1/5 роанрхномти ооцита [3]. Отсутствие микроворсинок в этой области, по-видмому, обусловлено присутствием в кортексе хромосом, которые не заключены в ядерную оболочку [4] [5]. Присоединение спермиев к этой области ооцита крайне редко [6]. Веретено метафазы II обычно не лежит непосредственно под первым полярным тельцем, а ~30–40° в сторону [7]. Сходное ротационное смещение (disparity) происходит между веретеном метафазы II и кластером митохондрий, который [2], продолжает маркировть место веретена метафазы I. Значит анимальный полюс определяется как место экструзии полярных телец, сдвиг его положения между первичной и вторичной стадией ооцита. Неизвестно как такая аксиальная ротация происходит и каково ее значение для будущего развития.
Ни один из признаков полярности не сохраняется на стадии зиготы у млекопитающих. У человека, в отличе от мыши, не обнаружено ни области свободной от микроворсинок, ни каких-либо видимых ограничений в месте присоединения спермиев [8]; однако существование паттерна цитоплазматических и пронуклеарных изменений обнаружено при использованиии видео съемки зигот человека при инъекции в цитоплазму спермия [9]. Тем не менее имеющиеся доказательства светововй и электронной микроскопии — которые получены у некоторых видов— подтверждают, что ооциты и зиготы млекопитающих не обнаруживают заметной полярности. Однако внутриклеточная локализация продуктов определенных генов на этой стадии показала, что лептин и STAT-3 kinase имеют одно и то же пространственно ограниченное субкортикальное расположение и в ооцитах и зиготах, которое ,по-видимому, сохраняется в течение всей стадии бластоциста [10]. Установлено, что ооцит лишен мРНК для обоих белков, которые первоначально обнаруживают сходную локализацию среди окружающих фолликулярных клеток. Лептин участвует в большом числе процессов помимо липидного метаболизма, однако неясно какова его роль и киназы, которая находится ниже его рецепторов, участвовать в раннем развитии. Эксперименты, предпринятые с целью удаления частей зиготы мыши или нарушения ее организации, не выявили эффекта на последующее развитие [11•] [12] хотя, как указывалось [13], они и не предоставли определенных доказательств против существования информации по фирмированию паттерна зародыша.
Дробление
Дробление
Хотя имеются типичные различия в величине бластомеров на двухклеточной стадии, однако эта тенденция варьирует в степени от зародыша к зародышу, указывая тем самым, что вряд ли имеет важное значение, это просто результат неточности деления цитоплазмы во время цитокинеза. Даже нормальная ориентация последовательных делений дробления все еще предмет споров. Первое дробление очевидно неслучайно в отношении анимально-вегетативной (animal–vegetal (AV) ) оси зиготы [12] правда не всегда, как иногда утверждается [14], строго меридионально, так как иногда обнаруживаются заметные отклонения от этой ориентации. Относительно второго деления дробления, имеется множество несоответствий каково типичное X-wise или tetrahedral расположение бластомеров на ранней стадии 4-х клеток [15]. Для третьего и последующих дроблений ситуация еще более запутанная. Радиальная организация обнаруживается благодаря полярности всех бластомеров с 8-клеточной стадии у мыши [16], процесс, который, по-видимому, появляется позднее и более ограничен у млекопитающих, у которых происходит больше длений дроления до бластуляции (blastulation) [17] [18]. У мышей судьба дочернего одного из 16 бластомеров зависит от ориентации цитокинеза в отношении полюса апикальных микроворсинок, который персистирует в течение всего митоза [19]. Имеет ли весь зародыш в целом значимую для развития полярность неясно. Однако доказано, что соотноешние внутренних и внешних клеток менее вариабельно после пятого нежели четвертого деления ддробления, это указывает на то, что ориентация плоскостей дробления наружных клеток чувствительна к числу внутренних клеток [20].
Бластоцист и стадия ранней гаструлы
Бластоцист и стадия ранней гаструлы
Формирование бластоцеля указывает на то, что зародыш мыши впервые располагает очевидной осью полярности, что морфологически проявляется фокальным прикреплением популяци внутренних клеток, внутренней клеточной массы (inner cell mass (ICM)) к наружному трофэктодермальному эпителию. Эта ось, которая известна как embryonic–abembryonic (Em.Ab) ось, консервируется при имплантации, когда ICM и лежащая сверху трофэктодерма растут в полость бластоцеля для образования яйцевого цилиндра (egg-cylinder). Уже перед этим зародыш радиально симметричен вокруг его Em.Ab оси вплоть до появления первичной полоски в начале гаструляции. Появились морфологические и молекулярные доказательства несостоятельности этого мнения.
Неизвестно, что детерминирует какая часть возникающей трофэктодермы ICM клеток останется присоединенной, когда начнется кавитация морулы [21], хотя это является предопределяющим в детерминации судьбы клеток трофэктодермы. Таким образом, хотя клетки муральной трофэктодремы, окружающие бластоцель, становятся детерминированными к политении уже в начале имплантации, полярные клетки, покрывающие ICM продолжают пролиферировать и следовательно, предназначены стать предшественниками всех производных поздней трофэктодермы. Получены доказательства участия FGF-4 в обеспечении зависимости пролиферации трофобласта на ICM [22•] [23•] [24]. Помимо их способа роста известны и другие различия между клетками полярной и муральной трофэктодермы [25] [26] [27] [28] [29] [30], по крайней мере, некоторые из которых связаны с фактом, что присоединение к эпителию матки во время имплантации обеспечивается муральной тканью. Более противоречивым является вопрос является ли продукция зоны лизина (zona lysin) характерным свойством муральных клеток [31] [32].
Вывод, что бластоцист мыши является скорее билатеральным, чем радиально симметричным вокруг Em.Ab оси перед имплантацией, исходит из изучения срезов in utero [33], и подтвержден на живом материале [34]. Возникает вопрос о происхождении и значении билатеральной оси бластоциста и остается ли она законсервированной на поздних стадиях развития. Ответа пока нет.
Билатеральная ось раннего бластоциста может в норме специфицироваться до начала дробления, используя втрое полярное тельце как маркер, постоянно обнаруживается ее совпадение с AV осью зиготы [35]. Факт, что зигота может развиваться нормально после удаления или анимального или вегететивного полярного региона [11•] говорит против зависимости спецификации билатеральной оси бластоциста от информации, локализованной в одном из этих мест. Однако необходимые сигналы должны быть хорошо делокализованы, если, например, они зависят от полярности цитоскелета зиготы в целом. Бластоцисты временно становятся радиально симметричными вокруг их Em.Ab оси во время экспансии перед восстановлением билатеральной формы, как только процесси закончен. Продвинутые бластоцисты отличаются от ранних тем. что имеют билатеральную ось, которая четко поляризована и может таким образом быть преобразована в набор из трех осей перед имплантацией [33] (see Fig. 1). Остается определить, законсервирована ли билатеральная ось от раннего к позднему бластоцисту и к гаструле, это кажется вероятным из-за выраженной и постоянной асимметрии, которой они оладают [36] [37]. Предполагается, что не только три оси зародыша мыши законсервированы в течение этого онтогенетчиеского перехода, но и что соответствующие оси возникающего плода соответствуют им [34] [37]. Однако, хотя AP ось будущего плода и билатеральная ось зародыша имеют одинаковоую ориентацию при гаструляции они часто оказываются оппозитными в отношении полярности[37]
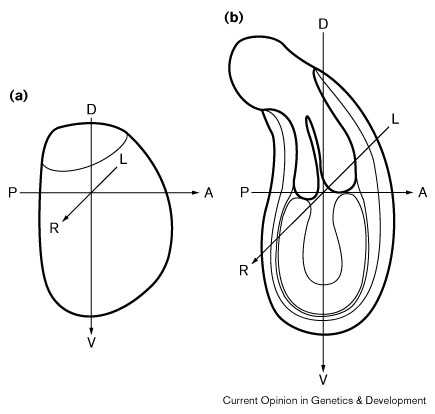 |
Рис 1 Схема, показывающая набор осей [33] [36] в целом зародыше на стадии (a) позднего бластоциста и (b) ранней гаструлы на базе соответсвующей асимметрии. Так как полярность AP оси плода часто антипараллельна таковой у зародыша [37], лишь их DVоси постоянно одинаковы. A, anterior; P, posterior; D, dorsal; V, ventral; L, left; R, right Figure 1 Diagrams to show set of axes assigned by Smith [33] [36] to the entire conceptus at the (a) late blastocyst and (b) early gastrula stage on the basis of corresponding asymmetry. As the polarity of the fetal AP axis is as often antiparallel as parallel to that of the conceptus [37], only theirDVaxes are consistently the same. A, anterior; P, posterior; D, dorsal; V, ventral; L, left; R, right. |
AP ось плода является также типично поперечной, чем параллельной длинной оси матки. Вероятность того, что сигналы от окружающей материнской ткани могут обеспечивать ориентацию осей плода, не является ничтожной. Во-первых, установлено, что спецификация AP оси плода не осуществляется последовательно от зади к переди, молекулярные указания передней дифференцировки выявляются еще до формирования первичной полоски [38•]. В частности четкие морфологические доказательства передней дифференцировки до гаструляции выявлены у кроликов [39]. Во-вторых, сигналы передней дифференцировки, по-видимому, исходят из вне-эмбриональной ткани, специфической части висцеральной энтодермы, окружающей эпибласт, который назван передней висцеральной энтодермой (anterior visceral endoderm ( AVE ) [40]. При данном очень экстенсивном перемешивании клеток, которое происходит в эпибласте при его трансформации из плотного узла ткани в псевдослойный эпителий [41], неудивительно, что информация, детерминирующая его AP дифференцировку располагается инициально в соседних тканях, которые сохраняют когерентный паттерн роста [42]. В-терьих, в экспериментах по маркированию клеток [43••] и при фенотипическом анализе зародышей, гомозиготных по двум дизруптивным генам, Smad 2 и Cripto [44] [45] [46•] было установлено, что будущая AP ось плода ротирует перед гаструляцией так что становится ортогональной длинной оси яйцевого цилиндра (i.e. исходной Em.Ab оси бластоциста) с которой она первоначально совпадала (see Fig. 2).
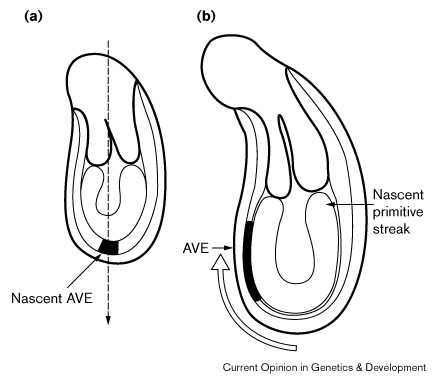 |
Рис 2 Схема, иллюстрирующая постулируемую ротацию AP оси плода. (a) Дистальная висцеральная энтодерма, которая является позитивной в отношении Hex транскриптов на 5.0 день postcoitum движется проксимально (открытая стрелка) так что с началом гаструляции она занимает область диаметрально противопложную первичной полоске, названа AVE [43••]. AP ось плода следовательно должна ротировать из первоначального совпадения сDVосью зародыша и плода Figure 2 Diagrams illustrating postulated rotation of the AP axis of fetus. (a) Distal visceral endoderm which is positive for Hex transcripts at 5.0 days postcoitum moves proximally (open arrow) so that by the onset of gastrulation it occupies a region diametrically opposite the primitive streak termed the AVE [43••]. The fetal AP axis is therefore presumed to rotate from an initial alignment with theDVaxis of conceptus and fetus. |
Растут доказательства того, что AVE у млекопитающих может выступать как отдельный организатор головы, это вызывает вопрос имеет ли она аналог, отделимый от организатора туловища у других позвоночных. Имеющиеся данные противоречивы. У кур аналог этой ткани, передний гиполаст, по-видимому, лишен подобной активности [47•]. Возникают сомнения играет ли гипобласт какую-либо роль в дифференцировке AP оси у эмбрионов птиц [48].
Подтверждение, что AVE играет такую индуктивную роль у млдекопитающих, базируется на наблюдении последствий прямого повреждения этой области висцеральной энтодермы [40] и инъекциях мутантных эмбриональных стволовых (embryonic stem (ES)) клеток в бластоцисты дикого типа и наоборот. Последние исследования, которые зависят от колонизации ES клетками внеэмбриональных тканей очень слобо по сравнению с эпибластом, показали, что гены, которые экспрессируются в AVE или во всей висцеральной энтодерме до эпибласта, являются генотипом энтодермы, который предопределяет фенотип ранней гаструлы (e.g. [49] [50]).
Заключение
Заключение
Изучение формирования паттерна в раннем развитии млекопитающих достигло стадии, когда, с одной стороны, новые данные достаточны для отказа от точки зрания на то, что радиальная симметрия имеет место вплоть до образования первичной полоски, с другой стороны, они все еще недостаточны для создания слаженной картины возникновения и основы ранней асимметрии, от которой, по-витдимому, зависит спецификация AP оси плода.