Проделан ряд работ по анализу микромассивов экспрессируемых генов во время развития печни [34-37]. Детали приведены в Box 1, вместе с данными библиотеки SAGE и новыми ресурсами для эмбриональных мРНК [38]. Учитывая, что нет еще универсальной платформы для профилей экспрессии, трудно сравнивать базы данных. Но тем не менее эти базы данных представляют собой исключительный ресурс для поиска генов кандидатов, участвующих в развитии печени.
Когда зачатки печени выделяются из энтодермы, то гепатобласты оказываются перед лицом принятия решения, дифференцироваться в гепатоциты или желчные эпителиальные клетки. В некоторых тканях путь Notch является интегральным для принятия решений о судьбе клеток и, по-видимому, действует и в печени. Мутации Notch лиганда Jagged-1 ассоциируют с синдромом Alagille
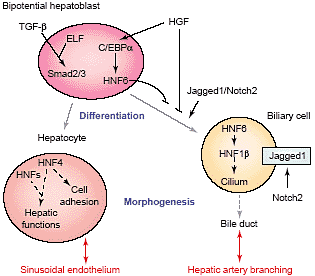 Factors influencing the differentiation of hepatoblasts into hepatocytes and biliary cells, and their morphogenetic induction of liver sinusoidal endothelium and hepatic artery branching.
Factors influencing the differentiation of hepatoblasts into hepatocytes and biliary cells, and their morphogenetic induction of liver sinusoidal endothelium and hepatic artery branching.
(OMIM #118450), аутосомно доминантным заболеванием, при котором печень характеризуется недостатком внутрипеченочных протоков. Также мыши двойные гетерозиготы по
Jag1 нулевому аллелю и гипоморфному
Notch2 аллелю воспроизводят синдром Alagille и обнаруживают отсутствие внутрипеченочных желчных протоков при рождении [39].К сожалению, нет пренатальных данных об этих мышах, которые позволяли бы объяснить различие ролей Notch пути в дифференцировке желчных клеток или в морфогенезе intrahepatic bile duct (IHBD). Экспрессия компонентов передачи сигналов Notch изучали в постнатальной печени [40-42] и в регенерирующей печени, где они м. участвовать в предопределении клеточных судеб и пролиферации [42,43]. Notch компонент,
Delta-like protein/preadipocyte factor 1/fetal antigen 1, экспрессируется во время предопределения судьбы гепатобластов [44].
Передача сигналов TGF-β также претендует на роль кандидата регулятора печеночных клонов (Рис. 2). Печень эмбрионов мышей, гетерозиготных по
Smad2/Smad3 [45] или дефицитных по ELF, адапторному белку в сигнальном каскаде TGF-β [46], показывает, что гепатоциты группируются в кластеры, вместо образования тяжей, которые экспрессируют пониженные количества α-fetoprotein. Культивируемые экспланты печени от Smad2
+/-/Smad3
+/- эмбрионов обнаруживают низкую и широко распространенную экспрессию cytokeratin вместо высокой экспрессии, ограниченной желчными клетками [45]. Эти фенотипические аспекты м.б. результатом аномальных клеточных контактов, вторичных по отношению пониженным уровням β1-integrin, обнаруживаемых в мутантной печени. Напротив, низкие уровни α-fetoprotein в купе с широко распространенной экспрессией cytokeratin также м. отражать дефицит способности гепатобластов дифференцироваться в направлении желчных или печеночных клонов. Последняя интерпретация базируется на наблюдении, что инкубация Smad2
+/-/Smad3
+/-
печеночных эксплантатов с HGF восстанавливает фенотип [45] а недавние данные подчеркивают, что HGF является регулятором бипотентности гепатобластов [47,48]. Т.е., albumin-негативные (alb
-) печеночные стволовые клетки, выделенные из печени эмбрионов мышей дают
in vitro albumin-позитивные клетки, если обработаны HGF. Клетки alb
+ м. дифференцироваться в направлении желчного и гепатоцитного клонов, указывая тем самым, что эти alb
+ клетки сравнимы с бипотентными гепатобластами, обнаруживаемыми в развивающейся печени. HGF способствует дифференцировке alb
+ клеток alb
- предшественников, но ингибирует дальнейшую дифференцировку alb
+ клеток в желчные клетки, указывая, что HGF способствует установлению бипотентного состояния гепатобластов.
Suzuki и др. [48] показали, что HGF индуцирует экспрессию
C/EBPa, транскрипционного фактора, многочисленного в печени, в изолированных alb
- клетках. Блокирование активности C/EBPa с помощью доминантно негативной мутации
C/EBPa предупреждает переход от alb
- стадии к alb
+ фенотипу, показывая, что HGF способствует бипотентности посредством C/EBPa. Интересно, что блокирование C/EBPa редуцирует также экспрессию
HNF6, тогда как умеренно индуцирует маркеры желчной дифференцировки CK19 и gGT. Это уменьшение HNF6, связанное с повышением желчной дифференцировки, прекрасно согласуется с предыдущими наблюдениями на нокаутных HNF6 мышах [49]. У таких мышей желчная дифференцировка является преждевременной и избыточной, указывая тем самым, что HNF6 необходим для ослабления раннего желчного предназначения и помогает регулировать бипотентность. Как TGFβ, HGF, C/EBPa и HNF6, a возможно и путь Notch интегрируются в когерентную сеть, которая контролирует бипотентность и делает возможной дальнейшую или желчную или гепатоцитную дифференцировку, становится критическим вопросом для понимания предопределения судеб клеток в ранней печени (Рис. 2). Прекрасным инструментом для изучения развития печени являются печеночные линии эмбрионов мышей, которые поддерживают свою способность дифференцироваться
in vitro и in vivoв направлении клонов гепатоцитов или желчных клеток [50,51] (F Lemaigre,
unpublished).
Differentiation and morphogenesis of the
biliary tract
Внепеченочный желчный тракт - желчный пузырь, пузырный, печеночный и общий желчные протоки - и IHBD развиваются отдельно и соединяются с помощью неизвестного механизма [52,53]. Осуществлена молекулярная характеристика внепеченочного желчного тракта и выявлены неожиданные взаимоотношения между развитием внепеченочного желчного протока и поджелудочной железы. Кроме того, достигнут определенный прогресс в идентификации генов, управляющих развитием внутрипеченочных желчных протоков в результате анализа мутантов мышей и болезней людей.
Работы группы Wright's показали, что панкреатический транскрипционный фактор Pdx1 экспрессируется в проксимальной части развивающегося общего желчного протока [54], а Sumazaki et al. [55] установили, что этот фактор обнаруживается в желчных эпителиальных клетках, выстилающих весь внепеченочный желчный тракт, хотя и на более низких уровнях, чем в поджелудочной железе (Рис. 1). Т.к.
Pdx1 не экспрессируется во внутрипеченочной части желчь-выносящего древа, то это отличает две части желчного тракта. В развивающейся поджелудочной железе Pdx1 маркирует плюрипотентные клетки предшественники из экзокринных ацинусов и эндокринных островков [56]. Эндокринные клетки происходят из субпопуляции Pdx
+ клеток, которые ко-экспрессируют проэндокринный фактор Ngn3. Экспансия этой Pdx
+/Ngn3
+ субпопуляции ограничена путем Notch, который посредством индукции репрессора Hes1, репрессирует экспрессию
Ngn3. Sumazaki et al. описали роль пути Notch в развитии желчных протоков и показали, что внепеченочные желчные протоки дифференцируются в панкреатическую ткань (экзокринную + эндокринную), если ген
Hes1 в нокауте [55]. Эта переориентация внепеченочного желчного древа в направлении панкреатической судьбы м. отражать низкий, но позитивный уровень Pdx1 в желчных клетках. Эктопическая панкреатическая эндокринная дифференцировка у
Hes1-/- эмбрионов ассоциирует в дерепрессией
Ngn3, который обычно не экспрессируется в желчных клетках дикого типа. Развитие IHBD, по-видимому, не меняется у эмбрионов
Hes1-/-. Итак, открыта неожиданная онтогенетическая пластичность внепеченочных желчных клеток и подчеркнута необходимость в тонко регулируемом пути Notch/Hes1/Ngn3 для поддержания статуса внепеченочной желчной дифференцировки.
Мыши, гаплонедостаточные по мезенхимному транскрипционному фактору Foxf1 обнаруживают аномалии желчного пузыря с уменьшением количества мезенхимных клеток, а иногда и с полным отсутствием эпителия желчного пузыря [57]. Ген-мишени для
Foxf1, необходимые для развития желчных протоков ещё не идентифицированы, но снижение уровня Notch2, обнаруживаемое в регенерирующей Foxf1
+/- печени позволяет предполагать, что Foxf1 регулирует передачу сигналов Notch во внепеченочных желчных протоках [58].
Морфогенез внутрипеченочного желчного тракта во многом известен.
Hnf6-/- эмбрионы или эмбрионы с печень-специфичной инактивацией гена
Hnf1β неспособны формировать IHBD [49,59]. Вместо этого, желчные клетки остаются нерегулярно организованными вокруг веточек портальной вены и формируют временные желчные кисты. Аномальный
тубулогенез, ассоциированный с образованием кист, является хорошо известным признаком polycystic kidney diseases (PKD), которая часто ассоциирует с желчными кистами. Известны некоторые гены, вызывающие PKD, а функция генных продуктов указывает на их активность в ресничках
[60]. Желчные эпителиальные клетки, подобно почечным клетки, имеют первичный cilium на апикальной поверхности, а нарушения образования ресничек ассоциируют с аномалиями желчных протоков [61]. Аутосомно рецессивная форма PKD (ARPKD), вызванная мутациями в гене
PKHD1, чей продукт - названный polyductin или fibrocystin [62,63] - обнаруживается в ресничках, включая реснички cholangiocyte [61]. У мутантных крыс (PCK крысы), fibrocystin неспособен попадать в реснички.
Реснички приобретают аномальную форму и возникают аномалии желчных протоков [61]. Установлена [64,65 ] связь между HNF1β и некоторыми генами, вызывающими PKD, включая
Pkhd1, т.к. было установлено, что эти гены соединяются и стимулируются с помощью HNF1β. Хотя в этой работе с HNF1β изучалась лишь регуляция гена в почках, очень возможно, что гены кистозной болезни, управляются с помощью HNF1β и в печени [66,67], это м. объяснить, почему HNF1β нокаутный печеночный фенотип [59] характеризуется желчными кистами. Считается, что экспрессия HNF1β стимулируется в печени с помощью HNF6 [49], м. рассматривать сеть с участием HNF6, HNF1β и ассоциированных с ресничками белков в контроле морфогенеза IHBD (Рис. 2). Тем не менее роль ресничек в возникновении желчных аномалий остается спекулятивной. Для гена
TG737/Polaris, который также кодирует белок, локализующийся в ресничках и мутации которого генерируют аномалии ресничек, ассоциированные с PKD и желчными кистами, предложена новая роль. В исследовании нервной системы мышей, несущих гипоморфный аллель
TG737/Polaris, группа Anderson показала. что этот ген необходим для передачи сигналов Hedgehog посредством процесса, который м. вовлекать реснички и/или внутриклеточный транспорт [68]. Участвует ли передача сигналов Hedgehog в развитии IHBD, пока остается открытым вопросом.
Hepatic artery development is linked to
intrahepatic bile duct morphogenesis
Между печеночными дольками IHBD всегда ассоциированы с веточками портальной вены и с одной или двумя веточками печеночной артерии, формируя портальную триаду. IHBD и печеночная артерия, как установлено, интимно связаны в ходе развития и при болезнях (Рис. 2). Веточки печеночной артерии у людей формируются вблизи ductal пластинки, тогда как у мышей они развиваются вблизи зрелых IHBDs [69]. Обработка крыс лекарством, которое стимулирует пролиферацию холангиоцитов, индуцирует параллельное ремоделирование печеночной артерии [70].
У мышей, дефицитных по HNF6 или HNF1β, веточки печеночной артерии не способны формироваться и клетки, экспрессирующие α-smooth
muscle actin накапливаются вокруг дизорганизованных желчных клеток [59,71]. Неожиданно у некоторых мышей обнаруживается избыток веточек печеночной артерии, это напоминает фенотип печеночной артерии, ассоциированный с некоторыми формами уродств ductal пластинки у людей. Несмотря на тот факт, что время образования веточек печеночной артерии отличается у мышей и людей, м. оперировать сходные механизмы, связывающие IHBD и артерии, это указывает на то, что исследования мутантных мышей м. позволить характеризовать нарушения развития печеночной артерии и у людей.
Putting it all together: the conditional HNF4a
mutation and liver morphogenesis
Как указывалось выше, транскрипционный фактор HNF4a соединяется с почти половиной транскрибируемых генов, тестированный в печени взрослых мышей [32]. Но генетическая оценка делеций HNF4a невозможна из-за его потребности в желточном мешке и ранней эмбриональной летальности [72].
Parviz et al. [73] поэтому создали 'floxed' аллель
HNF4a, в котором критический экзон фланкирован с помощью сайтов loxP. Гомозиготных мышей скрещивали с мышами, которые содержат
floxed аллель и cre recombinase трансген под контролем регуляторных элементов генов albumin и fetoprotein. В результате рекомбиназа вызывает делецию функции HNF4a в печени плода. HNF4a-мутантные плодные гепатоциты не способны экспрессировать многие, но не все, печень-специфичные гены, и были маленькими и округлыми и не ассоциировали в эпителий. Недостаточность эпителия м.б. объяснена отсутствием экспрессии белков клеточной адгезии, таких как E-cadherin и ZO1. Интересно, что ретровирусная трансдукция HNF4a в фибробласты индуцирует экспрессию этих белков и образование эпителиальных характеристик, но оказывается недостаточной для индукции экспрессии печень-специфичного гена. Т.о.. хотя HNF4a безусловно необходим для печеночной дифференцировки и эпителиальной морфологии, он достаточен только для индукции только последней и д.б. интегрирован в HNF регуляторную сеть, чтобы активировать или поддерживать экспрессию печеночных генов (Рис. 2). В дополнение к фенотипу печени у мутантов
HNF4a выявляются обширные кровоизлияния, обусловленные нарушениями образования синусоидального эпителия. Крупные сосуды присутствуют, но капилляры отсутствуют или разорваны. Простейшим объяснением является то, что синусоидальный эпителий обычно развивается после генерации эпителиальной структуры с помощью дифференцированных гепатоцитов
[73].
Conclusions
As many liver genes function in other tissues, including
HNF4a, floxed alleles and more tissue- and temporalspecific
cre lines will be needed to test gene function
during development, regeneration, homeostasis, and so
on. Still, taking the HNF4a studies with the aforementioned
coordination of hepatic artery and bile duct
formation, the field is beginning to generate a comprehensive
picture about how liver morphogenesis occurs
and a better understanding of how the diverse functions
of the hepatocyte are connected to the rest of the body.
This information will not only help understand liver
pathology, but may soon be used to guide stem-cell
differentiation and efforts to develop artificial organs.
Update
The Miyajima group recently showed [74] that Jagged-1
protein is found in cells adjacent to the biliary cells at the
onset of biliary differentiation and ductal plate formation.
They further showed that activation of Notch2 signalling
represses hepatoblast differentiation towards the hepatocyte
lineage. They propose an interesting model in which
Jagged1/Notch2 interaction is critical for induction of
biliary differentiation and repression of hepatocytic
differentiation.
Сайт создан в системе
uCoz
